
Wetenschap
Hoe berekent u standaard enthalpie van neutralisatiehydrochloorzuur en natriumchloride met behulp van CRC Handbook Chemistry Physics?
Inzicht in het concept:
* Standaard enthalpie van neutralisatie: Dit is de enthalpieverandering wanneer één mol zuur volledig reageert met één mol basis om één mol water te vormen onder standaardomstandigheden (298 K en 1 atm).
* CRC Handboek: Het CRC -handboek biedt uitgebreide thermodynamische gegevens, waaronder standaard enthalpen van formatie (ΔHF °) voor verschillende stoffen.
Het probleem:
Het CRC -handboek geeft u geen specifieke waarde voor de enthalpie van neutralisatie voor HCL en NaOH. In plaats daarvan moet u het berekenen met behulp van de wet van Hess.
Hoe de enthalpie van neutralisatie te berekenen:
1. Schrijf de gebalanceerde chemische vergelijking:
HCl (aq) + NaOH (aq) → NaCl (aq) + h₂o (l)
2. Vind de standaard enthalpieën van formatie (ΔHF °) voor elke reactant en product: Deze gegevens zijn direct beschikbaar in het CRC -handboek.
3. Pas de wet van Hess toe: De wet van Hess stelt dat de enthalpieverandering voor een reactie onafhankelijk is van het genomen pad, wat betekent dat deze kan worden berekend uit de enthalpieveranderingen van bekende reacties.
* ΔH ° (reactie) =σ [Δhf ° (producten)] - σ [ΔHf ° (reactanten)]]
4. Sluit de waarden aan:
* ΔH ° (neutralisatie) =[ΔHf ° (NaCl) + ΔHf ° (H₂o)] - [ΔHf ° (HCl) + ΔHf ° (NaOH)]
5. Bereken het resultaat: Vervang de waarden uit het CRC -handboek voor de AHF ° van elke verbinding.
Voorbeeld:
Laten we aannemen (deze waarden zijn alleen voor demonstratie, zoek ze op in uw CRC -handboek):
* ΔHf ° (NaCl) =-411,15 kJ/mol
* ΔHf ° (h₂o) =-285,83 kJ/mol
* ΔHf ° (HCl) =-167,16 kJ/mol
* ΔHf ° (NaOH) =-469,65 kJ/mol
Dan zou de berekening zijn:
* ΔH ° (neutralisatie) =[(-411.15) + (-285.83)]-[(-167.16) + (-469,65)] =-56,97 kJ/mol
Sleutelpunten:
* Zorg ervoor dat u de juiste eenheden (kj/mol) gebruikt.
* Controleer het dubbele dat de waarden die u uit het CRC-handboek gebruikt voor de standaardstatus (298 K en 1 atm) zijn.
* Vergeet niet dat de enthalpie van neutralisatie negatief zal zijn, omdat dit een exotherme reactie is (warmte wordt vrijgegeven).
Laat het me weten als je specifieke waarden hebt voor ΔHF ° uit het CRC -handboek, en ik kan je helpen de enthalpie van neutralisatie voor de HCL- en NaOH -reactie te berekenen.
 Wat is de term die wordt gegeven aan de stof die wordt geproduceerd door de papieren industrie die schadelijke organismen zijn?
Wat is de term die wordt gegeven aan de stof die wordt geproduceerd door de papieren industrie die schadelijke organismen zijn?  Panel kondigt Nobelprijs voor scheikunde 2020 aan
Panel kondigt Nobelprijs voor scheikunde 2020 aan Wat is de functie van drukvat een kernreactor?
Wat is de functie van drukvat een kernreactor?  Onderzoek naar nieuwe medicijnen kan de behoefte aan proefdieren drastisch verminderen
Onderzoek naar nieuwe medicijnen kan de behoefte aan proefdieren drastisch verminderen Waarom is veel kookpan gemaakt van aluminium, hoewel het een reactief metaal?
Waarom is veel kookpan gemaakt van aluminium, hoewel het een reactief metaal?
 Luchthaven Bali heropent, maar vulkaan spuwt nog steeds as
Luchthaven Bali heropent, maar vulkaan spuwt nog steeds as Droogte afgekondigd in verschillende delen van Engeland
Droogte afgekondigd in verschillende delen van Engeland Aqua-satelliet ziet tropische depressie Bolaven vechten tegen windschering
Aqua-satelliet ziet tropische depressie Bolaven vechten tegen windschering Waarom worden gele kikkers het meest waarschijnlijk in het bos gegeten?
Waarom worden gele kikkers het meest waarschijnlijk in het bos gegeten?  NASA vindt zware regen ten zuidwesten van tropische cycloon Uesis center
NASA vindt zware regen ten zuidwesten van tropische cycloon Uesis center
Hoofdlijnen
- Hoe pest werkt
- Wat is de functie van vette afzettingen?
- Waarom worden sommige aminozuren essentiële aminozuren genoemd?
- Kunnen we mannelijke en vrouwelijke protoceratopen gemakkelijk onderscheiden?
- Invasieve superschurkenkrab kan door zijn kieuwen heen eten
- Onderzoek toont aan dat regenererende wormen genetische controle hebben over hun algenpartners
- Cellen behoren tot een organisme in welk koninkrijk?
- Zeevruchten, wild of gekweekt? Het antwoord kan beide zijn
- Gemanipuleerde bacteriën zijn veelbelovend voor een duurzame biobrandstofindustrie, zeggen onderzoekers
- Een sprong in het gebruik van silicium voor batterijanoden
- Elektrisch geleidende verven en andere polymeerlegeringen nu gemakkelijk te produceren

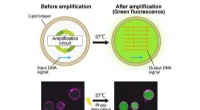
- Nieuwe DNA-amplificatiecapsule belooft veel voor de bestrijding van ziekten
- Nieuwe sensor detecteert waardevol terbium van zeldzame aardelementen uit niet-traditionele bronnen

- Supersmering op microschaal zou de weg kunnen effenen voor toekomstige verbeterde elektromechanische apparaten

 Wat betekent de vorm van een zonne -bekendheid?
Wat betekent de vorm van een zonne -bekendheid?  NASA-wetenschappers vinden uitputting van halogenen door gigantische impact
NASA-wetenschappers vinden uitputting van halogenen door gigantische impact Antarctica toerisme verordening dringend voor het milieu:top
Antarctica toerisme verordening dringend voor het milieu:top IJsmeltsnelheid in lucht op 80 graden?
IJsmeltsnelheid in lucht op 80 graden?  Kernfusie:hoe enthousiast moeten we zijn?
Kernfusie:hoe enthousiast moeten we zijn? Wat is tussen watermoleculen, veroorzaken oppervlaktespanning?
Wat is tussen watermoleculen, veroorzaken oppervlaktespanning?  Waarom was orkaan Lane zo onvoorspelbaar?
Waarom was orkaan Lane zo onvoorspelbaar? Onderzoekers ontwikkelen een nieuwe AI-tool voor snelle en nauwkeurige weefselanalyse ter ondersteuning van de ontdekking en diagnostiek van geneesmiddelen
Onderzoekers ontwikkelen een nieuwe AI-tool voor snelle en nauwkeurige weefselanalyse ter ondersteuning van de ontdekking en diagnostiek van geneesmiddelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

