
Wetenschap
Is waterstofbromide polair of niet -polair?
Waterstofbromide (HBR) is polair . Dit is waarom:
* Elektronegativiteitsverschil: Bromine (BR) is meer elektronegatief dan waterstof (H). Dit betekent dat Bromine de gedeelde elektronen in de H-BR-binding sterker aantrekt.
* ongelijke elektronenverdeling: De gedeelde elektronen besteden meer tijd dichter bij het broomatoom, waardoor een gedeeltelijke negatieve lading (δ-) op de broom en een gedeeltelijke positieve lading (δ+) op de waterstof ontstaat.
* Dipoolmoment: Deze ongelijke ladingsverdeling creëert een dipoolmoment, waarbij het ene uiteinde van het molecuul een positieve lading heeft en het andere uiteinde een negatieve lading heeft.
Daarom is HBR een polair molecuul.
 Wetenschappers gebruiken standaard kantoorscanners als hulpmiddel voor evaluatie van grondkleur
Wetenschappers gebruiken standaard kantoorscanners als hulpmiddel voor evaluatie van grondkleur Technologie, tijdelijke hulp houdt boeren langer aan het werk
Technologie, tijdelijke hulp houdt boeren langer aan het werk Onderzoekers volgen grondwaterlozingen in zoutvijvers
Onderzoekers volgen grondwaterlozingen in zoutvijvers Hoe beïnvloeden bomen biotisch en abiotisch?
Hoe beïnvloeden bomen biotisch en abiotisch?  Bomenvijanden helpen tropische bossen hun biodiversiteit te behouden
Bomenvijanden helpen tropische bossen hun biodiversiteit te behouden
Hoofdlijnen
- Wat is het eerste micro -organisme op aarde?
- Hoe zijn chromosomen in elke menselijke cel?
- Nieuwe experimenten bieden inzicht in hoe insecten vliegen en het ontwerpen van kleine vliegende robots
- Welke afkortingen voor enzymen die betrokken zijn bij de afbraak van glucose?
- Waarom wordt het totale eiwit gemeten bij 595 nm in Bio-Rad-test?
- Wat is het deel van een cel die fotosynthetes?
- Hernieuwde oproepen voor legale jacht om de groeiende berenpopulatie in Connecticuts onder controle te houden
- Wat is een functie die automatisch de waarden in cellen direct boven of links van actieve cel toevoegt?
- Afrikaanse slaapziekte:hoe de ziekteverwekker tseetseevliegen koloniseert
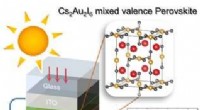
- Loodvrij, efficiënte perovskiet voor fotovoltaïsche cellen
- Wetenschappers gebruiken een blender om te onthullen wat er in onze smartphones zit

- Intense tests onthullen ongrijpbare, complexe vorm van gemeenschappelijk element

- Terwijl deze bacteriën eten, genereren ze een ongebruikelijk driehoekig molecuul dat kan worden gebruikt om vliegtuigbrandstof te maken
- Realtime dekking van de binnenkant van de hersenen mogelijk gemaakt
 Gebouwen verbruiken veel energie - zo ontwerp je hele gemeenschappen die evenveel teruggeven als nemen
Gebouwen verbruiken veel energie - zo ontwerp je hele gemeenschappen die evenveel teruggeven als nemen Onderwatermodderstromen vormen de grootste bedreiging voor offshore-boringen, en energiebedrijven zijn er niet klaar voor
Onderwatermodderstromen vormen de grootste bedreiging voor offshore-boringen, en energiebedrijven zijn er niet klaar voor Welke planeet draait de zon het langzaamst?
Welke planeet draait de zon het langzaamst?  Wetenschappers voorspellen veelbelovende nieuwe familie van materialen voor koeling in vaste toestand
Wetenschappers voorspellen veelbelovende nieuwe familie van materialen voor koeling in vaste toestand Hoe heet het als er geen maan zichtbaar is?
Hoe heet het als er geen maan zichtbaar is?  Onderzoekers bevorderen karakterisering, zuivering van nanobuisdraden en films
Onderzoekers bevorderen karakterisering, zuivering van nanobuisdraden en films Het menselijk hart in de ruimte:wat kunnen we leren van wiskundige modellering
Het menselijk hart in de ruimte:wat kunnen we leren van wiskundige modellering a Hoe Supernova werkt
a Hoe Supernova werkt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

