
Wetenschap
Waarom kan water veel stoffen oplossen?
1. Polariteit:
* Watermoleculen zijn Polar , wat betekent dat ze een enigszins positief uiteinde hebben (waterstofatomen) en een enigszins negatief uiteinde (zuurstofatoom).
* Met deze polariteit kunnen watermoleculen andere polaire moleculen aantrekken en interageren, zoals suikers en zouten.
* Het positieve uiteinde van het watermolecuul wordt aangetrokken door het negatieve uiteinde van het andere molecuul, en vice versa, waardoor waterstofbindingen worden gevormd .
2. Waterstofbinding:
* Waterstofbindingen zijn relatief zwak maar collectief sterk, waardoor water zijn samenhangende aard krijgt en het toestaat de moleculen van andere stoffen uit elkaar te trekken.
* De positieve waterstofatomen in een watermolecuul kunnen waterstofbruggen vormen met de negatieve zuurstofatomen van andere watermoleculen, evenals met andere moleculen.
3. Universeel oplosmiddel:
* Water wordt vaak het "universele oplosmiddel" genoemd omdat het een breed scala aan stoffen kan oplossen, niet alleen polaire moleculen.
* Dit komt door zijn hoge diëlektrische constante , wat betekent dat het de elektrostatische attracties tussen ionen in een stof kan verzwakken, waardoor ze kunnen scheiden en oplossen.
* Zout (NaCl) lost bijvoorbeeld op in water omdat de polaire watermoleculen de positief geladen natriumionen (Na+) en de negatief geladen chloride-ionen (Cl-) omringen en uit elkaar trekken.
4. Andere factoren:
* Temperatuur: Hogere temperaturen verhogen de kinetische energie van watermoleculen, waardoor ze effectiever zijn in het uiteenvallen van opgeloste moleculen.
* Druk: Hogere druk dwingt meer watermoleculen in contact met de opgeloste stof, waardoor de oplossingsnelheid wordt verhoogd.
Belangrijke opmerking: Hoewel water voor veel stoffen een uitstekend oplosmiddel is, kan het niet alles oplossen. Niet -polaire stoffen zoals olie en vet zijn bijvoorbeeld niet oplosbaar in water.
Samenvattend, het vermogen van water om veel stoffen op te lossen, stamt uit zijn polaire aard, vermogen om waterstofbruggen, hoge diëlektrische constante en de effecten van temperatuur en druk te vormen.
Hoofdlijnen
- Wat veroorzaakte het massale uitsterven van de eerste dieren op aarde?
- Hoe een bacterie de plasticvervuilingscrisis kan helpen oplossen
- Waarom is het Golgi-apparaat belangrijk en welke taak heeft het apparaat ons in ons lichaam geholpen?
- Wat is een andere naam voor somatische stamcellen en wat doen ze?
- Een parasiet volgen die vissen verwoest
- Hoeveel ATP-moleculen per glucose krijgt een cel bij elk van de drie stadia van cellulaire ademhaling?
- Waarom is het economie een empirische wetenschappen?
- Waarom wordt voedingsagar gebruikt voor bacteriën en geen schimmels?
- Door geplande experimenten online te volgen, kunnen manieren worden gevonden om dierproeven te verbeteren
- Wetenschappers ontwikkelen biorubberlijm voor sneller chirurgisch herstel en pijnverlichting
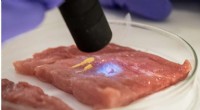
- Op groene fluorescerende eiwitten gebaseerde glucose-indicatoren voor realtime monitoring van het glucosemetabolisme
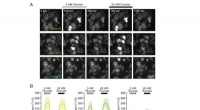
- Nieuw deactiveringsmechanisme voor gedetecteerde schakeleiwitten

- Botdiep:Mineraal gevonden in menselijk bot kan helpen bij het bestrijden van giftige organische stoffen
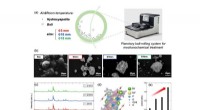
- Met gewone tape, onderzoekers maken chip die de ontwikkeling van medicijnen kan versnellen
 Verhoogt de toenemende temperatuur altijd de oplosbaarheid van een opgeloste stof in oplosmiddel?
Verhoogt de toenemende temperatuur altijd de oplosbaarheid van een opgeloste stof in oplosmiddel?  Welk gebied van wetenschap was Wegener deskundig?
Welk gebied van wetenschap was Wegener deskundig?  Wat is het twee-mixprincipe?
Wat is het twee-mixprincipe?  Hoe baart bacteriën je?
Hoe baart bacteriën je?  Wetenschappers programmeren eiwitten om precies te paren
Wetenschappers programmeren eiwitten om precies te paren Lahar-detectiesysteem geüpgraded voor Mount Rainier
Lahar-detectiesysteem geüpgraded voor Mount Rainier  Hoe lang zal de vulkaanuitbarsting in IJsland duren? Het hangt ervan af hoeveel magma eruit moet komen, zegt een expert
Hoe lang zal de vulkaanuitbarsting in IJsland duren? Het hangt ervan af hoeveel magma eruit moet komen, zegt een expert  Ingeslikte nanodeeltjes kunnen schadelijk zijn voor de gezondheid
Ingeslikte nanodeeltjes kunnen schadelijk zijn voor de gezondheid
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


