
Wetenschap
Waarom is loodchromaat niet oplosbaar in water?
1. Roosterergie:
* Leadchromaat heeft een zeer sterke ionische binding tussen de lood (PB
2. Hydratatie -energie:
* De hydratatie -energie van lood- en chromaationen is relatief laag. Dit betekent dat watermoleculen de ionen niet effectief omringen en stabiliseren wanneer ze worden opgelost.
3. Entropie:
* Het oplossen van loodchromaat zou de entropie van het systeem verhogen (meer aandoening). De winst in entropie is echter niet voldoende om de energie te overwinnen die nodig is om de sterke ionische bindingen te verbreken.
4. Gemeenschappelijk ioneneffect:
* Leadchromaat is nog minder oplosbaar in aanwezigheid van gewone ionen zoals lood (PB
2+
) of chromaat (cro 4
Samenvattend:
De sterke ionische bindingen in loodchromaat vereisen een grote hoeveelheid energie om te breken, die niet door water wordt geleverd. De lage hydratatie -energie en de entropische factoren dragen ook bij aan de onoplosbaarheid ervan.
Het is belangrijk op te merken dat hoewel loodchromaat in water als "onoplosbaar" wordt beschouwd, het een zeer kleine mate van oplosbaarheid vertoont. Dit betekent dat een kleine hoeveelheid loodchromaat oplost in water, maar de concentratie is extreem laag.
 Wat zijn de veel voorkomende aandoeningen die het gevolg kunnen zijn van blootstelling aan rottende materialen?
Wat zijn de veel voorkomende aandoeningen die het gevolg kunnen zijn van blootstelling aan rottende materialen?  Eerste observatie van hoe watermoleculen bewegen nabij een metalen elektrode
Eerste observatie van hoe watermoleculen bewegen nabij een metalen elektrode  Hoe weet je dat het karamelliseren van suiker een chemische verandering is?
Hoe weet je dat het karamelliseren van suiker een chemische verandering is?  Hoeveel atomen zitten er in totaal in drie moleculen tafelsuiker?
Hoeveel atomen zitten er in totaal in drie moleculen tafelsuiker?  Wat zijn de protonen en neutronen elektronen van koolstof?
Wat zijn de protonen en neutronen elektronen van koolstof?
 Hoe het de Groenlandse ijskap verging in 2018
Hoe het de Groenlandse ijskap verging in 2018 Difference Between Mosquito & Sand Fly Bites
Difference Between Mosquito & Sand Fly Bites  Grote Meren blijven stijgen; meren Michigan, Huron zal waarschijnlijk de records van september overtreffen
Grote Meren blijven stijgen; meren Michigan, Huron zal waarschijnlijk de records van september overtreffen Hoe glad water en zwarte schalie bij fracking samen radioactief afval produceren
Hoe glad water en zwarte schalie bij fracking samen radioactief afval produceren De opwarming van de aarde kan de oorzaak zijn van een toename van de frequentie en intensiteit van koude periodes
De opwarming van de aarde kan de oorzaak zijn van een toename van de frequentie en intensiteit van koude periodes
Hoofdlijnen
- Wat is een vrije of bewegende grenselektroforese?
- Welk cellenproces vindt plaats in de mitochondriën?
- Hoe beïnvloedt de biologie de journalistiek?
- Hoe wordt het genoemd als het ei en sperma versmelten buiten het lichaam?
- Tijger botten? Leeuw botten? Een bijna uitgestorven cycad? DNA-controles ter plaatse bij aankomsthavens
- Schippers dumpen afval in de wateren van Zuid-Florida? Tieners worden beschuldigd van misdrijf
- Wat wordt in het integumentaire systeem als dode cellen beschouwd?
- Wie patenteert wiens genoom?
- Wat is het belang van transport in planten en dieren?
- Elektrische schok tot koolstof maakt een betere waterzuiveraar
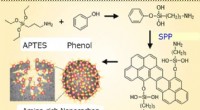
- Duurzame chemie op kwantumniveau

- Een nieuw ontdekte katalysator belooft goedkopere waterstofproductie
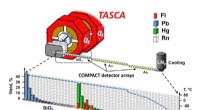
- Onderzoek toont aan dat flerovium het meest vluchtige metaal is in het periodiek systeem
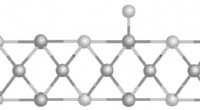
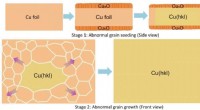
- Het afstemmen van het oppervlak geeft variaties op metaalfolies
 Wat is de elektrische lading van beryllium -ion?
Wat is de elektrische lading van beryllium -ion?  Waarom het coronavirus de bedreigde diersoorten in China kan helpen redden
Waarom het coronavirus de bedreigde diersoorten in China kan helpen redden  Wat is de naam van die grote platte rots in Wyoming?
Wat is de naam van die grote platte rots in Wyoming?  Is het vermogen om metalen te scheiden een fysische of chemische eigenschap?
Is het vermogen om metalen te scheiden een fysische of chemische eigenschap?  Record droogte grijpt Duitse graanschuur in de greep
Record droogte grijpt Duitse graanschuur in de greep Waarom wordt zink niet geëxtraheerd uit oxide door reductie met behulp van koolmonoxide?
Waarom wordt zink niet geëxtraheerd uit oxide door reductie met behulp van koolmonoxide?  Wat is de definitie van perculatie?
Wat is de definitie van perculatie?  Structuur-eigenschap relaties in nanoporeuze en amorfe iridiumoxiden
Structuur-eigenschap relaties in nanoporeuze en amorfe iridiumoxiden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

