
Wetenschap
Waarom vormen stikstof en zuurstof negatieve ionen maar niet positief in eenvoudige binaire verbindingen?
Dit is waarom:
* elektronegativiteit: Dit is de neiging van een atoom om elektronen naar zichzelf aan te trekken in een chemische binding. Stikstof en zuurstof hebben relatief hoge elektronegativiteitswaarden.
* Elektronenaffiniteit: Dit is de verandering in energie wanneer een elektron wordt toegevoegd aan een neutraal atoom. Stikstof en zuurstof hebben positieve elektronenaffiniteiten, wat een gunstige energieverandering aangeeft bij het verkrijgen van een elektron.
Deze eigenschappen maken het voor hen gemakkelijker om elektronen te winnen en negatief geladen ionen (anionen) te vormen in plaats van elektronen te verliezen en positief geladen ionen (kationen) te vormen.
Bijvoorbeeld:
* stikstof (n) heeft een elektronegativiteit van 3,04 en vormt het nitride -ion (n³⁻) in verbindingen zoals magnesiumnitride (mg₃n₂).
* Oxygen (O) heeft een elektronegativiteit van 3,44 en vormt het oxide -ion (o²⁻) in verbindingen zoals natriumoxide (Na₂o).
Waarom geen positieve ionen?
Stikstof en zuurstof zouden elektronen moeten verliezen om positieve ionen te vormen. Dit zou echter een aanzienlijke hoeveelheid energie vereisen om de sterke aantrekkingskracht tussen hun kern en hun elektronen te overwinnen. Het is energetisch ongunstig voor hen om elektronen te verliezen en kationen te worden in eenvoudige binaire verbindingen.
Uitzonderingen:
Hoewel stikstof en zuurstof typisch anionen vormen, zijn er enkele uitzonderingen waar ze positieve ionen kunnen vormen in complexe verbindingen en onder specifieke omstandigheden.
Bijvoorbeeld:
* stikstof kan een kation vormen in verbindingen zoals NO₂⁺ (nitroniumion) waar het een sterke binding vormt met zuurstof.
* zuurstof Kan kationen vormen in verbindingen zoals o₂²⁺ (dioxygen dication) onder extreme omstandigheden zoals in aanwezigheid van sterke oxidatoren.
In eenvoudige binaire verbindingen maken hun hoge elektronegativiteit en gunstige elektronenaffiniteit het echter veel waarschijnlijker dat ze elektronen krijgen en anionen vormen.
 Platform met hoge doorvoer maakt het in kaart brengen van activiteiten van opkomende kankergeneesmiddelen mogelijk
Platform met hoge doorvoer maakt het in kaart brengen van activiteiten van opkomende kankergeneesmiddelen mogelijk Wat zorgt ervoor dat een verbinding wordt gevormd uit elementen?
Wat zorgt ervoor dat een verbinding wordt gevormd uit elementen?  Welke heeft de hoogste elektronenversterking en enthalpie tussen chloor en fluor waarom?
Welke heeft de hoogste elektronenversterking en enthalpie tussen chloor en fluor waarom?  Belangrijke tricyclische chemische verbindingen met efficiënte chiraliteitscontrole
Belangrijke tricyclische chemische verbindingen met efficiënte chiraliteitscontrole Hoeveel liter vloeibaar petroleumgas levert één kg gas op?
Hoeveel liter vloeibaar petroleumgas levert één kg gas op?
 Inslag van asteroïden verrijkt bepaalde elementen in zeewater
Inslag van asteroïden verrijkt bepaalde elementen in zeewater Hoe Megalodon Teeth
Hoe Megalodon Teeth Zal de oceaan profiteren van de strijd om het verbod op microbeads?
Zal de oceaan profiteren van de strijd om het verbod op microbeads? Welke rol speelde gras bij het behoud van de bodem van Prairies?
Welke rol speelde gras bij het behoud van de bodem van Prairies?  Een omslag in de oceaancirculatie die heeft bijgedragen aan het beëindigen van de ijstijd
Een omslag in de oceaancirculatie die heeft bijgedragen aan het beëindigen van de ijstijd
Hoofdlijnen
- De eerste warmbloedige dinosaurussen zijn mogelijk 180 miljoen jaar geleden ontstaan
- Wat zijn de verschillende rollen in het wetenschapsonderzoeksteam?
- De kern van het kweken van cowpea onder moeilijke omstandigheden
- Wat betekent codominonce bij genetici?
- Waar bevinden de oorbotten of de gehandelsels zich?
- Wat worden de gegevens weergegeven in een cel?
- Wordt de ontwikkeling van de theorie altijd onderdeel van de wetenschappelijke methode?
- Aussie slangen en hagedissen gaan terug tot Azië 30 miljoen jaar geleden
- Welke structuur wordt de mannelijke gametofyt?
- Onderzoekers laten zien dat materialen vanzelf sterker worden wanneer ze met zeer hoge snelheid worden geraakt
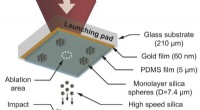
- Gasmaskerfilters bestuderen zodat mensen gemakkelijker kunnen ademen

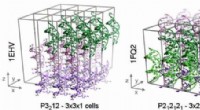
- Wetenschappers bereiken de eerste stabiele simulaties van DNA-kristallen
- Schimmelenzymen kunnen het geheim bevatten om hernieuwbare energie uit hout te maken

- Mechanische ingenieurs ontwikkelen proces om piëzo-elektrische materialen in 3D te printen

 Internet-glasvezel kan waardevol inzicht bieden in geologische verschijnselen
Internet-glasvezel kan waardevol inzicht bieden in geologische verschijnselen Stopt mitochondriën niet meer functioneren in een eencellig organisme dat wordt blootgesteld aan verontreinigende stoffen duidt op het orgaansysteem?
Stopt mitochondriën niet meer functioneren in een eencellig organisme dat wordt blootgesteld aan verontreinigende stoffen duidt op het orgaansysteem?  Wat gebeurt er als ijzeren nagels worden geplaatst in kopersulfaatoplossing. Write Word -vergelijkingen van de betrokken reacties?
Wat gebeurt er als ijzeren nagels worden geplaatst in kopersulfaatoplossing. Write Word -vergelijkingen van de betrokken reacties?  Wat zijn enkele echte uitspraken over ongelijke verwarming van land en water?
Wat zijn enkele echte uitspraken over ongelijke verwarming van land en water?  Hoe gelijke ladingen in enzymen biochemische reacties controleren
Hoe gelijke ladingen in enzymen biochemische reacties controleren  Welke maat voor de atmosfeer vertelt ons hoeveel vibratie -energie lucht bevat per massa -eenheid?
Welke maat voor de atmosfeer vertelt ons hoeveel vibratie -energie lucht bevat per massa -eenheid?  Wat is 91007500 in wetenschappelijke notatie?
Wat is 91007500 in wetenschappelijke notatie?  Virtuele realiteit zou kunnen dienen als krachtig hulpmiddel voor milieueducatie
Virtuele realiteit zou kunnen dienen als krachtig hulpmiddel voor milieueducatie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

