
Wetenschap
Wat is de Lewis -structuur voor ammoniumchloride?
Lewis -structuur voor ammoniumion (NH₄⁺)
1. stikstof (n): Stikstof heeft 5 valentie -elektronen.
2. waterstof (H): Elke waterstof heeft 1 valentie -elektron.
3. Totale valentie -elektronen: 5 (n) + 4 (1) (h) =9. Aangezien het een kation is met een +1 lading, trekken we één elektron af:9 - 1 =8.
4. plaatsing: Stikstof is het centrale atoom en de vier waterstofatomen omringen het.
5. bindingen: Elk waterstofatoom vormt een enkele covalente binding met stikstof, met behulp van 8 elektronen in totaal (4 bindingen x 2 elektronen/binding =8).
6. Formele ladingen: Stikstof heeft een formele lading van +1 en elke waterstof heeft een formele lading van 0.
Lewis -structuur voor chloride -ion (CL⁻)
1. chloor (CL): Chloor heeft 7 valentie -elektronen.
2. Totale valentie -elektronen: 7. Aangezien het een anion is met een -1 lading, voegen we één elektron toe:7 + 1 =8.
3. plaatsing: Chloor is het centrale atoom.
4. Elektronen: Chloor heeft 8 valentie -elektronen eromheen, weergegeven als 4 paar stippen.
5. Formele ladingen: Chloor heeft een formele lading van -1.
Representatie van ammoniumchloride (NH₄CL):
De Lewis -structuren van NH₄⁺ en CL⁻ worden gecombineerd om ammoniumchloride weer te geven. De positieve lading op het ammoniumion trekt de negatieve lading aan op het chloride -ion en vormt een ionische binding.
Diagram:
[NH₄⁺] [Cl⁻]
Sleutelpunten:
* Ammoniumchloride is een ionische verbinding gevormd door elektrostatische aantrekkingskracht tussen ammoniumionen (NH₄⁺) en chloride -ionen (CL⁻).
* De Lewis -structuren van de individuele ionen zijn belangrijk om de binding en structuur van de verbinding te begrijpen.
* Er is geen enkele Lewis -structuur voor de hele verbinding omdat het een ionische verbinding is.
Vergeet niet dat de Lewis -structuur helpt bij het visualiseren van de verdeling van valentie -elektronen in een molecuul of ion.
 Wat is de massa van 9,30 mol SiH4 in gram?
Wat is de massa van 9,30 mol SiH4 in gram?  Onderzoekers systematiseren de methoden voor de synthese van azocine-bevattende systemen
Onderzoekers systematiseren de methoden voor de synthese van azocine-bevattende systemen Een eenvoudige methode ontwikkeld voor 3D-biofabricage op basis van bacteriële cellulose
Een eenvoudige methode ontwikkeld voor 3D-biofabricage op basis van bacteriële cellulose Eiwit vermengt zich onder blauw licht
Eiwit vermengt zich onder blauw licht Heeft CA2 hetzelfde aantal elektronen als edelgasargon?
Heeft CA2 hetzelfde aantal elektronen als edelgasargon?
 In veel gebieden zijn mensen een niet -inactieve soort wat gebeurt er wanneer wordt geïntroduceerd in een bepaalde omgeving?
In veel gebieden zijn mensen een niet -inactieve soort wat gebeurt er wanneer wordt geïntroduceerd in een bepaalde omgeving?  Meeuwen:schildwachten van bacteriën in de omgeving
Meeuwen:schildwachten van bacteriën in de omgeving COP24:Hoe een plasticverdrag onze oceanen zou kunnen opruimen
COP24:Hoe een plasticverdrag onze oceanen zou kunnen opruimen Wetenschap-wat is een andere term voor staten?
Wetenschap-wat is een andere term voor staten?  De energie van de zon wordt beschikbaar gesteld aan vijvergemeenschap via activiteitenorganismen bij?
De energie van de zon wordt beschikbaar gesteld aan vijvergemeenschap via activiteitenorganismen bij?
Hoofdlijnen
- Wat is de functie van mitochondria in een plantencel?
- Nieuw boek van biologen beschrijft een nieuw tijdperk in de studie van evolutie
- Evolutie van de geslachten:wat een schimmel ons kan vertellen
- Biomechanica-team ontdekt hoe insecten hun 'botten' repareren
- Kunnen honden snel woorden leren?
- Welke eigenschappen hebben draken?
- Hoe nitraat de genexpressie in peulvruchten reguleert
- Genoomsequenties laten zien hoe lemuren infecties bestrijden
- Wat is vergelijkbaar met chloroplasten en mitochondria?
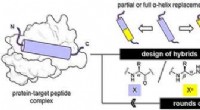
- Oligourea-foldamers bootsen peptiden alfa-helices na en binden effectief aan medicijndoelen
- Wetenschappers ontdekken dat watermicrodruppels kunnen veranderen in waterstofperoxide wanneer ze condenseren op koude oppervlakken

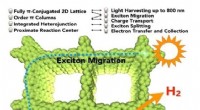
- Fotokatalytische waterstofproductie uit water
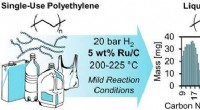
- Een milde manier om plastic in flessen te upcyclen tot brandstof en andere hoogwaardige producten
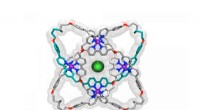
- Moleculaire knoop wint record voor 's werelds strakste
 Bewijs van voormalige vulkanische activiteiten wordt vaak gevonden in de enorme accumulaties die lava heeft genoemd?
Bewijs van voormalige vulkanische activiteiten wordt vaak gevonden in de enorme accumulaties die lava heeft genoemd?  Sedimentaire rotsen die zijn gemaakt van grote kiezelstenen en stenen hebben een grofkorrelige?
Sedimentaire rotsen die zijn gemaakt van grote kiezelstenen en stenen hebben een grofkorrelige?  De gebaren van Italianen en Zweden variëren wanneer ze verhalen vertellen, wat erop kan wijzen dat culturen anders over verhalen denken
De gebaren van Italianen en Zweden variëren wanneer ze verhalen vertellen, wat erop kan wijzen dat culturen anders over verhalen denken  Te nat? Te koud? Te heet? Zo beïnvloedt het weer de reizen die we maken
Te nat? Te koud? Te heet? Zo beïnvloedt het weer de reizen die we maken Wat doodt zeeotters? Wetenschappers lokaliseren parasietstam
Wat doodt zeeotters? Wetenschappers lokaliseren parasietstam  Het verhaal van een golf:van door de wind geblazen rimpelingen tot breken op het strand
Het verhaal van een golf:van door de wind geblazen rimpelingen tot breken op het strand Nieuw model voor het meten van de beweging van de ijskap kan de voorspellingen van de zeespiegelstijging verbeteren
Nieuw model voor het meten van de beweging van de ijskap kan de voorspellingen van de zeespiegelstijging verbeteren Nieuwe kosteneffectieve methode kan lage concentraties farmaceutisch afval en verontreinigingen in water detecteren
Nieuwe kosteneffectieve methode kan lage concentraties farmaceutisch afval en verontreinigingen in water detecteren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

