
Wetenschap
Welk volume in ml van een calciumhydroxide -oplossing van 0,03455 m zou nodig zijn om volledig te reageren met 32,76 0,0215 fosforzuuroplossing?
1. Schrijf de gebalanceerde chemische vergelijking:
3CA (OH) ₂ (aq) + 2h₃po₄ (aq) → ca₃ (po₄) ₂ (s) + 6h₂o (l)
2. Bepaal de molverhouding van de gebalanceerde vergelijking:
De gebalanceerde vergelijking toont aan dat 3 mol calciumhydroxide (Ca (OH) ₂) reageert met 2 mol fosforzuur (H₃po₄).
3. Bereken de mol fosforzuur:
* Moles =Molarity × Volume (in liters)
* Mol h₃po₄ =0,0215 m × 0,03276 l =0,000705 mol
4. Bereken de mol calciumhydroxide nodig:
* Gebruik de molverhouding van de gebalanceerde vergelijking:(3 mol ca (oh) ₂ / 2 mol h₃po₄)
* Mol ca (oh) ₂ =(0,000705 mol h₃po₄) × (3 mol ca (oh) ₂ / 2 mol h₃po₄) =0,0010575 mol ca (oh) ₂
5. Bereken het volume van calciumhydroxide -oplossing:
* Volume =mol / molariteit
* Volume van Ca (OH) ₂ =0,0010575 mol / 0,03455 m =0,0306 l
6. Converteer het volume naar milliliter:
* Volume in ml =0,0306 L × 1000 ml/L = 30,6 ml
Daarom zou u 30,6 ml van de 0,03455 m calciumhydroxide -oplossing nodig hebben om volledig te reageren met 32,76 ml van de 0,0215 m fosforzuuroplossing.
 Wat is een vochtscheider van nucleaire reactor?
Wat is een vochtscheider van nucleaire reactor?  Het verschil tussen gietijzer en gietstaal
Het verschil tussen gietijzer en gietstaal Een nieuw materiaal voor de batterij van de toekomst
Een nieuw materiaal voor de batterij van de toekomst Wat is het groene neerslag bij het bereiden van chroomoxalaatcomplexen?
Wat is het groene neerslag bij het bereiden van chroomoxalaatcomplexen?  Een verandering van de zee voor plasticvervuiling:nieuw materiaal breekt biologisch af in oceaanwater
Een verandering van de zee voor plasticvervuiling:nieuw materiaal breekt biologisch af in oceaanwater
 Stijgende CO2 kan gevaarlijke weersextremen vergroten, wat er ook gebeurt met de mondiale temperaturen
Stijgende CO2 kan gevaarlijke weersextremen vergroten, wat er ook gebeurt met de mondiale temperaturen Nieuw klimaatmodel voor het IPCC
Nieuw klimaatmodel voor het IPCC Wat veroorzaakt meer extreme neerslag in het noordoosten?
Wat veroorzaakt meer extreme neerslag in het noordoosten? Geef een voorbeeld van niet-levend ding dat twee kenmerken levende dingen geeft?
Geef een voorbeeld van niet-levend ding dat twee kenmerken levende dingen geeft?  Voor zeegras, biodiversiteit is zowel een doel als een middel voor herstel
Voor zeegras, biodiversiteit is zowel een doel als een middel voor herstel
Hoofdlijnen
- Zijn er eencellige organismen met chloroplast?
- Experiment laat zien hoe wormgastheren en het bijbehorende microbioom gezamenlijk bijdragen aan aanpassing aan het milieu
- Wat is Enterobiology?
- Wat is een vergelijking voor genotype?
- In welke soorten cellen worden chloroplast gevonden?
- Hoe Hydra-dieren hun eigen hoofd regenereren
- Een organisme dat zowel de dominante als recessieve versies van een bepaalde eigenschap draagt, is een?
- Biologen ontdekken hoe 'stille' mutaties de eiwitproductie beïnvloeden
- Hoe transporteren dragereiwitten stoffen door het celmembraan?
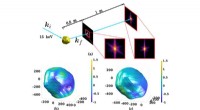
- Nieuwe rekentechniek lost gecomprimeerde röntgengegevens op
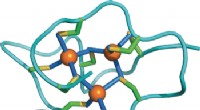
- Zwaar metaalbindend domein in een cysteïnerijk eiwit kan de aanpassing van de zeeslak aan metaalstress zijn
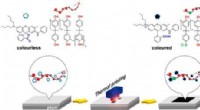
- Een stap in de richting van het kwijtraken van kassabonnen van BPA
- Betaalbare katalysator voor recycling van kooldioxide

- Giftige PFAS detecteren met een sensor ter grootte van een chip

 Leuke 5th Grade Pumpkin Math Activiteiten
Leuke 5th Grade Pumpkin Math Activiteiten  Hoe laat begint de zon onder te gaan?
Hoe laat begint de zon onder te gaan?  Heeft een hybride allel er maar één voor eigenschap?
Heeft een hybride allel er maar één voor eigenschap?  Hoeveel is 99,4 f in Celsius?
Hoeveel is 99,4 f in Celsius?  Opgravingen tonen aan dat het afgelegen Griekse eilandje een vroeg industrieel centrum was
Opgravingen tonen aan dat het afgelegen Griekse eilandje een vroeg industrieel centrum was  Cellen lopen een beetje zoals gekko's op vloeistoffen
Cellen lopen een beetje zoals gekko's op vloeistoffen Lasereilanden:onderzoeker laat zien hoe VCSELs volledig op silicium kunnen worden geïntegreerd
Lasereilanden:onderzoeker laat zien hoe VCSELs volledig op silicium kunnen worden geïntegreerd  Computationele origami:een universele methode om 3D-gebogen oppervlakken te omwikkelen met niet-rekbare materialen
Computationele origami:een universele methode om 3D-gebogen oppervlakken te omwikkelen met niet-rekbare materialen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

