
Wetenschap
Hoeveel waterstofatomen zijn er in 6,00 mol ammoniumsulfide?
1. Chemische formule:
* Ammoniumsulfide heeft de chemische formule (NH₄) ₂S.
2. Waterstofatomen per molecuul:
* Elk ammoniumion (NH₄⁺) bevat 4 waterstofatomen.
* Er zijn twee ammoniumionen in elk molecuul ammoniumsulfide.
* Daarom heeft elk molecuul ammoniumsulfide 4 * 2 =8 waterstofatomen.
3. Avogadro's nummer:
* Het nummer van Avogadro vertelt ons dat er 6.022 x 10²³ moleculen in één mol van elke stof zijn.
4. Berekening:
* Begin met het aantal mol ammoniumsulfide:6,00 mol
* Vermenigvuldig met het nummer van Avogadro om het aantal moleculen te vinden:6,00 mol * (6.022 x 10²³ Moleculen/mol) =3,61 x 10²⁴ moleculen
* Vermenigvuldig het aantal moleculen met het aantal waterstofatomen per molecuul:3,61 x 10²⁴ moleculen * 8 waterstofatomen/molecuul =2,89 x 10²⁵ waterstofatomen
Antwoord: Er zijn ongeveer 2,89 x 10²⁵ waterstofatomen in 6,00 mol ammoniumsulfide.
 Selectie van molecuulgewichtpolymeer door eendimensionale opsluiting
Selectie van molecuulgewichtpolymeer door eendimensionale opsluiting Het onthullen van verborgen fasen van materie door de kracht van licht
Het onthullen van verborgen fasen van materie door de kracht van licht Wat is de vergelijking voor het verbranden van pamoëzuur?
Wat is de vergelijking voor het verbranden van pamoëzuur?  Wat is de naam van het kopersulfaat nadat het is verwarmd?
Wat is de naam van het kopersulfaat nadat het is verwarmd?  Metaal in het midden van reactieve serie-of een allegaartje?
Metaal in het midden van reactieve serie-of een allegaartje?
 Wat is een interactie tussen de geosfeer en de biosfeer die de atmosfeer beschadigt?
Wat is een interactie tussen de geosfeer en de biosfeer die de atmosfeer beschadigt?  NASA vindt zware regenval in het oog van grote orkaan Maria
NASA vindt zware regenval in het oog van grote orkaan Maria Welke rol spelen wind en oceaan in het klimaat?
Welke rol spelen wind en oceaan in het klimaat?  Wetenschappers onderzoeken de tropopauze om vroege signalen van aanhoudende sterke regenval te vinden
Wetenschappers onderzoeken de tropopauze om vroege signalen van aanhoudende sterke regenval te vinden Laura's restjes gaan naar het oosten, een ramp achterlatend in Louisiana
Laura's restjes gaan naar het oosten, een ramp achterlatend in Louisiana
Hoofdlijnen
- Wat is het verschil tussen de biologische term fitness en de algemene betekenis van het woord?
- Onderzoek naar de genetica van macroalgen werpt licht op hoe zeewier meercellig werd
- Stimuleer stereotypen consumentenaankopen bij organisaties met of zonder winstoogmerk?
- Hoe insecten verschillende suikers uit elkaar houden
- Het krimpen van plantencellen wanneer water vertrekt zodat het celmembraan wegtrekt, wordt opgeroepen?
- Bijen gebruiken patronen, niet alleen kleuren, om bloemen te vinden
- Hoe kleurt licht perzikschillen rood?
- Multicellulaire organismen reproduceren door binaire splijting is waar?
- Wat zijn de drie belangrijkste verschillen tussen een plantencel en een dierlijke cel?
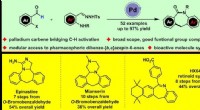
- Modulaire benadering van dibenzo-gefuseerde ε-lactams door middel van carbeen overbruggende CH-activering
- Nieuwe AI-tool berekent materiaalspanning en -rek op basis van foto's
- Meest gedetailleerde röntgenfoto van batterijen tot nu toe om te laten zien waarom ze nog steeds niet goed genoeg zijn

- Fluorescentiepatronen helpen bij medische diagnostiek

- De innerlijke werking van een levende cel in kaart brengen
 Welk deel haalt gember uit de plant?
Welk deel haalt gember uit de plant?  Wat is 6370000 m in wetenschappelijke notatie?
Wat is 6370000 m in wetenschappelijke notatie?  Hoe kun je je verkleden als Chloor?
Hoe kun je je verkleden als Chloor?  De zwerm schudden – onderzoekers onderzoeken hoe bijen samenwerken om zwermclusters te stabiliseren
De zwerm schudden – onderzoekers onderzoeken hoe bijen samenwerken om zwermclusters te stabiliseren  Noordelijke drift uit Gondwanaland wordt verondersteld ongeveer te zijn begonnen met welke miljoen jaar?
Noordelijke drift uit Gondwanaland wordt verondersteld ongeveer te zijn begonnen met welke miljoen jaar?  Welke satellieten hebben Planet Mercury onderzocht?
Welke satellieten hebben Planet Mercury onderzocht?  Kan de handel in eekhoorns hebben bijgedragen aan de middeleeuwse uitbraak van lepra in Engeland?
Kan de handel in eekhoorns hebben bijgedragen aan de middeleeuwse uitbraak van lepra in Engeland? Wat is de beste term die de ruimte rondom een magneet beschrijft waarin kracht werkt?
Wat is de beste term die de ruimte rondom een magneet beschrijft waarin kracht werkt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

