
Wetenschap
Welk element bevat atomen die gekleurde ionen vormen en meer dan één positieve oxidatietoestand hebben?
Dit is waarom:
* gekleurde ionen: Overgangsmetalen hebben gedeeltelijk gevulde D -orbitalen. Wanneer deze orbitalen specifieke golflengten van licht absorberen en andere opnieuw uitoefenen, beschouwen we dit als kleur.
* Meerdere oxidatietoestanden: Overgangsmetalen kunnen verschillende aantallen elektronen verliezen van hun D -orbitalen, wat resulteert in meerdere positieve oxidatietoestanden. Dit vermogen om de oxidatietoestand te veranderen, is wat hen in staat stelt een verscheidenheid aan gekleurde verbindingen en ionen te vormen.
Voorbeelden:
* koper: Kan +1 en +2 oxidatietoestanden hebben, die blauwe Cu (I) -ionen en groene Cu (II) ionen vormen.
* ijzer: Kan +2 en +3 oxidatietoestanden hebben, waardoor lichtgroene Fe (II) ionen en geelbruine Fe (III) -ionen worden gevormd.
* Mangaan: Kan +2, +3, +4, +6 en +7 oxidatietoestanden hebben, elk met verschillende kleuren.
Laat het me weten als je specifieke overgangsmetalen en hun verbindingen wilt verkennen!
 Nieuw materiaal verlaagt het energieverbruik in verband met de productie van ethyleen
Nieuw materiaal verlaagt het energieverbruik in verband met de productie van ethyleen Wat is het verschil tussen iconische en covalente bindingen?
Wat is het verschil tussen iconische en covalente bindingen?  Welk gas dat door zowel planten als dieren wordt gebruikt, is een product van fotosynthese?
Welk gas dat door zowel planten als dieren wordt gebruikt, is een product van fotosynthese?  Welk instrument kan worden gebruikt om een mol vaste opgeloste stofdeeltjes te meten?
Welk instrument kan worden gebruikt om een mol vaste opgeloste stofdeeltjes te meten?  Zijn de twee primaire gassen gevonden in de atmosfeer?
Zijn de twee primaire gassen gevonden in de atmosfeer?
 Klimaatverandering, houtkap botst - en een bos krimpt
Klimaatverandering, houtkap botst - en een bos krimpt Effect van werveldoding in oceanen is niet langer een kwestie van giswerk
Effect van werveldoding in oceanen is niet langer een kwestie van giswerk Het ontrafelen van de mechanismen van SST-opwarming in de Gele Zee en de Oost-Chinese Zee is nog steeds een uitdaging
Het ontrafelen van de mechanismen van SST-opwarming in de Gele Zee en de Oost-Chinese Zee is nog steeds een uitdaging Astma, lagere cijfers, dakloosheid:hoe klimaatverandering de Amerikaanse kinderen zal schaden
Astma, lagere cijfers, dakloosheid:hoe klimaatverandering de Amerikaanse kinderen zal schaden  Hoeveel elementen kunnen niet in de natuur worden gevonden?
Hoeveel elementen kunnen niet in de natuur worden gevonden?
Hoofdlijnen
- Welke klasse van enzymen hoort Lactase te zijn?
- Is de witte bloedcellen een dierlijke cel of een plantencel?
- Is er een plant die insuline hormoon produceert?
- Je politieke opvattingen kunnen voorspellen hoe je bepaalde woorden uitspreekt
- Hoe maak je een conceptkaart uit cel koolhydraten eiwit -enzymen DNA -suiker lipiden nucleotiden aminozuren en nucleïnezuur?
- Zombievirussen op een kapingsreis:hoe retrovirale genfragmenten embryonale cellen beïnvloeden
- Wanneer een organisme voor het eerst in het ecosysteem wordt geïntroduceerd en geen roofdieren heeft, wat gaat het dan doen?
- Wat is de vloeistof in een chloroplast die enzymen bevat die betrokken zijn bij de synthese van koolhydraten tijdens fotosynthese?
- Hoe wordt een expert van biologie genoemd?
- Synthese van tetrafenylammonium:bevestiging van het bestaan van het fantoomion
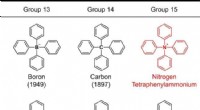
- Het probleem oplossen:organische damp veroorzaakt het oplossen van moleculaire zouten

- Eiwitkameleon kleurt langetermijngeheugen
- Gefermenteerde zuivelproducten beter laten smaken

- Wetenschappers onderzoeken de structuur van een sleutelgebied van telomerase-eiwit met een lange levensduur
 Wat is het einde van dit woord vergelijking natrium plus ijzercarbonaat?
Wat is het einde van dit woord vergelijking natrium plus ijzercarbonaat?  Is de zon heter aan de oppervlakte of in het midden?
Is de zon heter aan de oppervlakte of in het midden?  Wat is het belang van wetenschap voor de mens?
Wat is het belang van wetenschap voor de mens?  Kunnen alle sterrenstelsels behalve onze eigen blote oog gezien worden?
Kunnen alle sterrenstelsels behalve onze eigen blote oog gezien worden?  Wanneer is de wind op de maan gecreëerd?
Wanneer is de wind op de maan gecreëerd?  Wat voor soort stof is geleidend wanneer opgelost in water?
Wat voor soort stof is geleidend wanneer opgelost in water?  Waarom retourzendingen van klanten ertoe leiden dat bedrijven geld verliezen
Waarom retourzendingen van klanten ertoe leiden dat bedrijven geld verliezen  Welk element wordt als het meest veelzijdig beschouwd in levende organismen en waarom?
Welk element wordt als het meest veelzijdig beschouwd in levende organismen en waarom?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

