
Wetenschap
Welke metaaloxiden zullen niet reageren met koolstof?
Hier is een uitsplitsing:
* De reactie: Metaaloxiden reageren met koolstof om het metaal- en koolstofdioxide te produceren:
`` `
MO + C → M + CO₂
`` `
* stabiliteit: De reactie zal alleen doorgaan als de producten (metaal en koolstofdioxide) stabieler zijn dan de reactanten (metaaloxide en koolstof).
* Gibbs vrije energie: Gibbs vrije energie (ΔG) is een thermodynamische eigenschap die de spontaniteit van een reactie aangeeft. Een negatieve Ag geeft een spontane reactie aan, terwijl een positieve AG een niet-spontane reactie aangeeft.
* stabiliteit versus Gibbs vrije energie: Stabielere verbindingen hebben een meer negatieve AG van vorming.
Daarom zal metaaloxiden met een hogere AG van vorming dan kooldioxide niet reageren met koolstof.
Voorbeelden van metaaloxiden die niet reageren met koolstof:
* aluminiumoxide (al₂o₃)
* magnesiumoxide (MGO)
* calciumoxide (Cao)
* titaniumoxide (Tio₂)
Opmerking: Dit is een algemene regel en er zijn uitzonderingen. Sommige metaaloxiden kunnen bijvoorbeeld reageren met koolstof bij zeer hoge temperaturen. Onder normale omstandigheden worden de hierboven genoemde metaaloxiden echter als stabiel beschouwd en zullen ze niet reageren met koolstof.
 Wat is de betekenis van een elektronegativiteitsverschil tussen 1,7 en 2 atomen?
Wat is de betekenis van een elektronegativiteitsverschil tussen 1,7 en 2 atomen?  Wat kan er gezegd worden over de reactie bij 500K?
Wat kan er gezegd worden over de reactie bij 500K?  Hoeveel waterstofatomen zijn nodig om samen te voegen met stikstofvorm een stabiele verbinding?
Hoeveel waterstofatomen zijn nodig om samen te voegen met stikstofvorm een stabiele verbinding?  Heeft de rotsmica een chemische samenstelling?
Heeft de rotsmica een chemische samenstelling?  Weerspiegelt de zuurgraad van een oplossing de vrije waterstofionen in oplossing?
Weerspiegelt de zuurgraad van een oplossing de vrije waterstofionen in oplossing?
 Science Fair-projecten over bonen groeien en de levenscyclus
Science Fair-projecten over bonen groeien en de levenscyclus Lijst van vissen die bodemaanvoerders zijn
Lijst van vissen die bodemaanvoerders zijn Studie voorspelt hoe luchtverontreinigende stoffen uit Amerikaanse bosbodems zullen toenemen als gevolg van de klimaatverandering
Studie voorspelt hoe luchtverontreinigende stoffen uit Amerikaanse bosbodems zullen toenemen als gevolg van de klimaatverandering  Kwelders op de proef gesteld in golfgoot
Kwelders op de proef gesteld in golfgoot  Het is officieel:de afgelopen vijf jaar waren de warmste ooit gemeten
Het is officieel:de afgelopen vijf jaar waren de warmste ooit gemeten
Hoofdlijnen
- Wat is de betekenis van de wetenschappelijke methode?
- Soorten redeneren in geometrie
- Hoe stelt de structuur van microtubuli hen in staat om blijkbaar van de ene locatie een cel te verplaatsen?
- Waar vindt reductie plaats in een elektrolytische cel?
- Een groep gespecialiseerde cellen vormt eerst een?
- Waarom moeten cellen een optimaal intern milieu behouden?
- Is RNA koolhydraateiwitlipide of nucleïnezuur?
- Wat gebeurt er als er geen coördinatie is in de activiteiten van organismen?
- Welk micro -organisme verafelt afval?
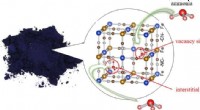
- Een blauw pigment dat een hoogwaardig ammoniakadsorbens blijkt te zijn
- Nieuwe methode van warmtegeleiding kan een game changer zijn voor serverparken en vliegtuigen

- Ingenieurs kunnen ultrazeldzame eiwitten in bloed detecteren met behulp van een mobiele camera

- Microbiële gemeenschappen blijven gezond door kennis uit te wisselen
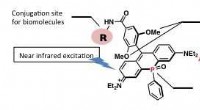
- Een nabij-infrarood fluorescerende kleurstof voor bio-imaging op lange termijn
 Tropische storm Barijat lijkt ongeorganiseerd voor NASA-NOAA-satelliet
Tropische storm Barijat lijkt ongeorganiseerd voor NASA-NOAA-satelliet Hoe berekent u de versnelling in de ruimte?
Hoe berekent u de versnelling in de ruimte?  Pretiene kinderen hebben de neiging om genialiteit te associëren met mannen, studie vondsten
Pretiene kinderen hebben de neiging om genialiteit te associëren met mannen, studie vondsten Productie van biobrandstoffen:een kwestie van rijden onder invloed?
Productie van biobrandstoffen:een kwestie van rijden onder invloed?  IJsland herdenkt eerste gletsjer die verloren is gegaan door klimaatverandering
IJsland herdenkt eerste gletsjer die verloren is gegaan door klimaatverandering Eerste echt zwarte zonnepanelen rollen van industriële productielijn
Eerste echt zwarte zonnepanelen rollen van industriële productielijn Nieuwe ontwerpstrategie kan helpen bij het verbeteren van gelaagde supergeleidende materialen
Nieuwe ontwerpstrategie kan helpen bij het verbeteren van gelaagde supergeleidende materialen Wanneer doen producten (en geld) je letterlijk watertanden?
Wanneer doen producten (en geld) je letterlijk watertanden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

