
Wetenschap
Wat is de elektronenconfiguratie van broom?
1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P⁵
Hier is een uitsplitsing:
* 1S²: Het eerste energieniveau (n =1) heeft 2 elektronen in het orbitaal.
* 2s² 2p⁶: Het tweede energieniveau (n =2) heeft 2 elektronen in de s orbitale en 6 elektronen in het P -orbitaal.
* 3S² 3P⁶: Het derde energieniveau (n =3) heeft 2 elektronen in de s orbitale en 6 elektronen in het P -orbitaal.
* 4S² 3D¹⁰: Het vierde energieniveau (n =4) heeft 2 elektronen in de s orbitale en 10 elektronen in het D -orbitaal.
* 4p⁵: Het vierde energieniveau (n =4) heeft 5 elektronen in het P -orbitaal.
Belangrijke opmerking: Vergeet niet dat het invullen van orbitalen de heerschappij van Hund en het AUFBAU -principe volgt. De 4S orbitale vult vóór de 3D -orbital, maar de 3D -orbital bevindt zich eigenlijk op een iets lager energieniveau.
 Schrijven met licht op titanium:herschrijfbare UV-gevoelige oppervlakken gemaakt van gedoteerde TiO2-nanokristallen
Schrijven met licht op titanium:herschrijfbare UV-gevoelige oppervlakken gemaakt van gedoteerde TiO2-nanokristallen Hoe röntgenstralen in de materie genetischtoxische elektronen met lage energie creëren
Hoe röntgenstralen in de materie genetischtoxische elektronen met lage energie creëren  Bevat alcohol stikstof in zijn chemische structuur?
Bevat alcohol stikstof in zijn chemische structuur?  Waarom heeft aniline een hoog kookpunt voor fenol en dan tolueenbenzeen?
Waarom heeft aniline een hoog kookpunt voor fenol en dan tolueenbenzeen?  Een carboxylgroep brengt waterstofionen in water uit, dus het is een organisch?
Een carboxylgroep brengt waterstofionen in water uit, dus het is een organisch?
 Wat gebeurt er precies als we geen water meer hebben?
Wat gebeurt er precies als we geen water meer hebben?  Duurzame bio-energie uit inheemse prairies op verlaten landbouwgronden
Duurzame bio-energie uit inheemse prairies op verlaten landbouwgronden Aziatische watertorens met krapper budget ondanks warmer en natter klimaat
Aziatische watertorens met krapper budget ondanks warmer en natter klimaat Wetenschappers komen samen om ozon te bestuderen, een atmosferisch mysterie in de buurt van Lake Michigan
Wetenschappers komen samen om ozon te bestuderen, een atmosferisch mysterie in de buurt van Lake Michigan NASA tuurt in de regenval van de tropische storm Aletta . in de oostelijke Stille Oceaan
NASA tuurt in de regenval van de tropische storm Aletta . in de oostelijke Stille Oceaan
Hoofdlijnen
- Is de term cerebrale dominantie het halfrond aan dat dominant is voor taal?
- Wat gebeurt er met een Zygote na de bevruchting?
- Hoe heten oceanen?
- Een wetenschapper maakt een afbeelding van alle chromosomen. Welke techniek gebruikt ze?
- Wat zijn reproduceerbare experimenten?
- Wat zijn 2 soorten permanente weefsels?
- Is muis een carnivoor herbivoor of omnivore?
- High School Biology Experiment Ideas
- Toch niet zo verschillend:menselijke cellen, winterharde microben delen een gemeenschappelijke voorouder
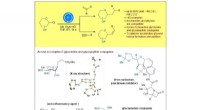
- Titaniumkatalyse maakt stereoselectieve synthese van C-glycosiden en glycopeptiden mogelijk
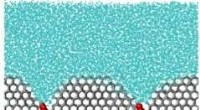
- Polymeren te hulp! Cellen beschermen tegen beschadiging van ijs
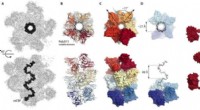
- Wetenschappers maken beelden van antilichamen die samenwerken tegen malaria
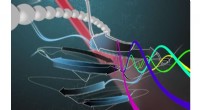
- Snelle screeningmachine kan eiwitsequenties lezen en scheiden
- Zeewater binnen enkele minuten drinkbaar maken

 Katten in een kooi:nieuwe hybride nanokooien voor snellere katalyse
Katten in een kooi:nieuwe hybride nanokooien voor snellere katalyse Natuurkundigen veranderen potlood in metaforisch goud
Natuurkundigen veranderen potlood in metaforisch goud  Wordt biomassa geproduceerd als gevolg van de ademhaling van planten?
Wordt biomassa geproduceerd als gevolg van de ademhaling van planten?  Ontbossing door kleine boeren blijkt de belangrijkste reden te zijn voor bosverlies in het Congobekken
Ontbossing door kleine boeren blijkt de belangrijkste reden te zijn voor bosverlies in het Congobekken Onderzoekers trekken een enkel kwantum licht af van een laserstraal
Onderzoekers trekken een enkel kwantum licht af van een laserstraal Amerikaanse fabrikant 3M zegt 2 te snijden, 000 banen bij afnemende vraag
Amerikaanse fabrikant 3M zegt 2 te snijden, 000 banen bij afnemende vraag Hoe lang is de periode van revolutie voor elke planeet rond de zon?
Hoe lang is de periode van revolutie voor elke planeet rond de zon?  Kan een wiskundestudent gaan voor biotechnologie?
Kan een wiskundestudent gaan voor biotechnologie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

