
Wetenschap
Sommige stoffen verdampen gemakkelijker dan andere omdat ze condenseren op koude oppervlakken kan worden verwarmd Atomsferische druk veranderen niet van vloeistof naar vaste passdampstaat of h?
* intermoleculaire krachten zijn de aantrekkelijke krachten tussen moleculen. Deze krachten bepalen hoe strak moleculen in een vloeistof bij elkaar worden gehouden.
* verdamping is het proces waarbij moleculen ontsnappen uit de vloeibare fase en de gasfase binnenkomen.
* sterkere intermoleculaire krachten Gemiddelde moleculen worden steviger bij elkaar gehouden, waardoor het moeilijker is om los te breken en te verdampen.
* Zwakkere intermoleculaire krachten Gemiddelde moleculen worden minder strak bij elkaar gehouden, waardoor het voor hen gemakkelijker kan ontsnappen en verdampen.
Laten we eens kijken waarom de andere opties onjuist zijn:
* Ze condenseren op koude oppervlakken: Condensatie is het tegenovergestelde van verdamping, waarbij gasmoleculen vloeibaar worden. Hoewel stoffen die gemakkelijk verdampen, ook gemakkelijk condenseren, is dit niet de reden voor hun gemak van verdamping.
* kan worden verwarmd: Hoewel verwarming de verdampingssnelheid verhoogt, verklaart het niet waarom sommige stoffen gemakkelijker verdampen dan andere bij dezelfde temperatuur.
* Atmosferische druk: Atmosferische druk kan de snelheid van verdamping beïnvloeden (lagere druk maakt het eenvoudiger), maar het bepaalt niet welke stoffen gemakkelijker verdampen.
* Verander niet van vloeistof naar vaste stof: Dit is niet relevant voor het gemak van verdamping. Alle vloeistoffen kunnen verdampen, zelfs die die ook stollen.
* Pass -dampstatus: Alle stoffen die verdampen gaan door een dampstaat. Dit is niet de reden voor verschillen in verdampingspercentages.
Samenvattend: Het gemak van verdamping wordt voornamelijk bepaald door de sterkte van de intermoleculaire krachten tussen moleculen. Stoffen met zwakkere intermoleculaire krachten verdampen gemakkelijker.
 Wat gebeurt er met de 3PGA -moleculen?
Wat gebeurt er met de 3PGA -moleculen?  Welk type recion vormt één groot molecuul uit twee of meer kleinere?
Welk type recion vormt één groot molecuul uit twee of meer kleinere?  Wat is een uitgebalanceerde chemische vergelijking voor calciumnitraat en natriumsulfaat?
Wat is een uitgebalanceerde chemische vergelijking voor calciumnitraat en natriumsulfaat?  Een veelbelovend doelwit voor nieuwe RNA-therapieën die nu toegankelijk zijn
Een veelbelovend doelwit voor nieuwe RNA-therapieën die nu toegankelijk zijn  Wetenschappers ontdekken nieuwe scheikunde die de oorsprong van cellulair leven kan helpen verklaren
Wetenschappers ontdekken nieuwe scheikunde die de oorsprong van cellulair leven kan helpen verklaren
 Braakliggende landbouwgrond voor veevoer is de eenvoudigste manier om het westerse watertekort te verminderen
Braakliggende landbouwgrond voor veevoer is de eenvoudigste manier om het westerse watertekort te verminderen Het winterweervenster dat koolzaadtelers miljoenen kost
Het winterweervenster dat koolzaadtelers miljoenen kost Een geschiedenis van het paleoklimaat in het zuidoosten van Australië reconstrueren
Een geschiedenis van het paleoklimaat in het zuidoosten van Australië reconstrueren Aarde saai miljard jaar stilstaand, stinkende oceanen waren misschien nogal dynamisch
Aarde saai miljard jaar stilstaand, stinkende oceanen waren misschien nogal dynamisch Duitse klimaatgroepen plannen juridische stappen tegen autoreuzen
Duitse klimaatgroepen plannen juridische stappen tegen autoreuzen
Hoofdlijnen
- Wat zijn de menselijke systemen in Rome?
- Wat is de kleinste parasiet?
- Wat noemde wetenschapper de moderne kijk op celmembraanstructuur wat?
- Cameravallen en andere goedkope gegevensbronnen vormen de basis voor ecologiestudies en inspanningen voor natuurbehoud
- Nieuwe aanwijzingen uit hersenstructuren van bidsprinkhaangarnalen
- Waarom verschilt de kleur van twee groepencellen?
- Met software kunnen onderzoekers kleine ronde voorwerpen uit DNA maken. Dit is waarom dat cool is
- De menselijke X- en Y -chromosomen zijn wat?
- Zijn dierenmigraties sociaal?
- Chemici onthullen de eerste manier om selenium in natuurlijke producten in te brengen
- Duurzaamheid van nieuw creosootalternatief bevestigd
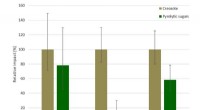
- 'S Werelds kleinste sensor meet groeikracht van planten, dieren en mensen

- Klittenbandachtige voedselsensor detecteert bederf en besmetting

- Onderzoekers passen voor het eerst 2D-spectroscopie toe op geïsoleerde moleculaire systemen
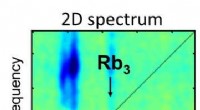
 Wat zijn de voorbeelden van elektromagnetische energie?
Wat zijn de voorbeelden van elektromagnetische energie?  Wat eet Aziatische damekevers?
Wat eet Aziatische damekevers?  Facebook lokte adverteerders door advertentieweergavetijden tot 900 procent op te blazen:rechtszaak
Facebook lokte adverteerders door advertentieweergavetijden tot 900 procent op te blazen:rechtszaak Welke planeet kantelt als het zo roteert dat de zon deze noordelijke en zuidelijke helften alternatief verwarmt?
Welke planeet kantelt als het zo roteert dat de zon deze noordelijke en zuidelijke helften alternatief verwarmt?  Wat is de formule van salicylaldehyde en neutraal ijzerchloride?
Wat is de formule van salicylaldehyde en neutraal ijzerchloride?  Optofluidische krachtinductie zorgt voor realtime karakterisering van nanodeeltjes
Optofluidische krachtinductie zorgt voor realtime karakterisering van nanodeeltjes Hoe bewegen deeltjes in vloeistof?
Hoe bewegen deeltjes in vloeistof?  Wat vermindert hergebruik en recylcle?
Wat vermindert hergebruik en recylcle?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

