
Wetenschap
Hoeveel stikstofmoleculen zitten er in een ballon?
* Ballongrootte: Een kleine ballon zal veel minder moleculen hebben dan een gigantische.
* gasdruk: Hoe hoger de druk in de ballon, hoe meer moleculen het vasthoudt.
* Gassamenstelling: Hoewel ballonnen meestal worden gevuld met lucht, wat meestal stikstof is, kan het exacte percentage stikstof enigszins variëren.
Om het aantal stikstofmoleculen te berekenen, zou u nodig hebben:
1. Het volume van de ballon: Dit vertelt u de hoeveelheid ruimte die het gas inneemt.
2. De druk in de ballon: Dit geeft aan hoe strak de moleculen zijn verpakt.
3. De temperatuur van het gas: Temperatuur beïnvloedt de kinetische energie van de moleculen en dus hun beweging.
Met deze informatie kunt u de ideale gaswet gebruiken:
* pv =nrt
* P =druk
* V =volume
* n =aantal mol gas
* R =ideale gasconstante
* T =temperatuur
dan kunt u mol gas omzetten in het aantal moleculen met behulp van het nummer van Avogadro (6.022 x 10^23 moleculen per mol).
Laat het me weten als je meer details over de ballon hebt en ik kan je helpen met de berekening!
 Nieuw elektronisch apparaat detecteert explosieve dampen
Nieuw elektronisch apparaat detecteert explosieve dampen Wat zou verwijzen naar de oxidatie van glucosepyrodruivenzuur?
Wat zou verwijzen naar de oxidatie van glucosepyrodruivenzuur?  Wat is het aantal atomen in AL2SO 3?
Wat is het aantal atomen in AL2SO 3?  Antibacteriële sportkleding? De claim is net zo absurd als het klinkt
Antibacteriële sportkleding? De claim is net zo absurd als het klinkt Nieuw ontdekte enzymcomplexen in het spijsverteringskanaal van herbivoren zijn veelbelovend voor duurzame brandstoffen en medicijnen
Nieuw ontdekte enzymcomplexen in het spijsverteringskanaal van herbivoren zijn veelbelovend voor duurzame brandstoffen en medicijnen
 Ongekend ijsverlies in Russische ijskap
Ongekend ijsverlies in Russische ijskap Microplastics worden over het hoofd gezien in rivierecosystemen, 50 procent van zoetwaterinsecten besmet
Microplastics worden over het hoofd gezien in rivierecosystemen, 50 procent van zoetwaterinsecten besmet Waarom is een kwaliteit dat deel van de aard van de personen?
Waarom is een kwaliteit dat deel van de aard van de personen?  Een nieuwe beleidsbrief voor CO2-neutraliteit voor gemeenten wereldwijd
Een nieuwe beleidsbrief voor CO2-neutraliteit voor gemeenten wereldwijd Toxiciteit van Mimosa Tree
Toxiciteit van Mimosa Tree
Hoofdlijnen
- Wat is de definitie van enzym?
- Stadsmuis of landmuis? Bioloog verzamelt muizen uit huizen om te onderzoeken hoe ze zo goed zijn geworden in het leven in de stad
- Wat is diploïde eukaryotisch?
- Waarom fruitvliegjes een goed genetisch model zijn voor onderzoek naar ziekten bij de mens
- Waarom reproduceren zoogdieren?
- Wat is een drievoudige nucleotiden die de code voor één aminozuur?
- Welke 2 dingen worden gevonden in een plantencel maar geen menselijke cel?
- Wetenschappers werpen licht op hoe gestresste cellen eiwitvormende mRNA's sekwestreren
- Zijn er mitochondriën in een dierlijke cel?
- Het mysterie van katalysatoren ontrafelen

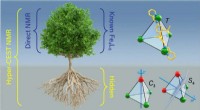
- Hyper-CEST NMR-techniek onthult ontbrekende structuur van een nieuw containermolecuul
- Slim medicijnontwerp om resistentie tegen malariabehandeling te voorkomen

- Een eenvoudige methode ontwikkeld voor 3D-biofabricage op basis van bacteriële cellulose

- Chemici remmen een kritische versnelling van celonsterfelijkheid
 Hoe emoties het werkleven vormgeven
Hoe emoties het werkleven vormgeven Zal klimaatverandering leiden tot het uitsterven van een nieuw ontdekte tarantulasoort?
Zal klimaatverandering leiden tot het uitsterven van een nieuw ontdekte tarantulasoort?  De molariteit van een oplossing verhogen
De molariteit van een oplossing verhogen afnemende kwaliteit van het werk, geen baanverlies, markeert volgend decennium van magazijnwerk
afnemende kwaliteit van het werk, geen baanverlies, markeert volgend decennium van magazijnwerk Grote veranderingen op komst voor de wereldwijde ruimtevaartindustrie
Grote veranderingen op komst voor de wereldwijde ruimtevaartindustrie Waarom moet de regenmeter ten minste 15-18 of 30 centimeter boven de grond zijn?
Waarom moet de regenmeter ten minste 15-18 of 30 centimeter boven de grond zijn?  Welke energietransformatie is wanneer een vogel worm eet?
Welke energietransformatie is wanneer een vogel worm eet?  Klimaatmodellen en geologie onthullen nieuwe inzichten in de Oost-Aziatische moesson
Klimaatmodellen en geologie onthullen nieuwe inzichten in de Oost-Aziatische moesson
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

