
Wetenschap
Het chlooratoom heeft 7 elektronen in zijn buitenste schaal 8 zal het stabiel maken wat moet stabiel worden?
* Chloor's elektronenconfiguratie: Chloor heeft 17 elektronen. De elektronenconfiguratie is 2-8-7, wat betekent dat het 7 elektronen heeft in de buitenste schaal (de derde schaal).
* De octetregel: Atomen zijn meestal het meest stabiel wanneer ze 8 elektronen in hun buitenste schaal hebben (met uitzondering van waterstof en helium, die slechts 2 nodig hebben). Dit staat bekend als de Octet -regel.
* Chloor's behoefte aan stabiliteit: Aangezien chloor 7 elektronen in zijn buitenste schaal heeft, heeft het nog een elektron nodig om een stabiel octet te bereiken.
Hoe chloor stabiliteit bereikt:
Om stabiel te worden, kan chloor:
* Krijg een elektron: Dit vormt een chloride-ion (Cl-), dat een negatieve lading heeft. Dit is een gebruikelijke manier waarop chloor stabiliteit bereikt in ionische verbindingen.
* Deel een elektron: Chloor kan covalente bindingen vormen met andere atomen door elektronen te delen. Dit is hoe chloor moleculen vormt zoals chloorgas (CL2).
Kortom: Chloor moet één elektron krijgen om stabiel te worden. Het kan dit bereiken door ionische bindingen of covalente bindingen te vormen.
 Onderzoekers op het gebied van kerntechnologie ontwikkelen nieuwe, veerkrachtige, met oxidedispersie versterkte legering
Onderzoekers op het gebied van kerntechnologie ontwikkelen nieuwe, veerkrachtige, met oxidedispersie versterkte legering Een natuurlijk geïnspireerde, herbruikbaar systeem dat water zuivert en zichzelf opbouwt
Een natuurlijk geïnspireerde, herbruikbaar systeem dat water zuivert en zichzelf opbouwt Kunnen mest en compost werken als probiotica, waardoor de antibioticaresistentie in stedelijke bodems wordt verminderd?
Kunnen mest en compost werken als probiotica, waardoor de antibioticaresistentie in stedelijke bodems wordt verminderd?  Wat zorgt ervoor dat protonen bij elkaar blijven in de kern?
Wat zorgt ervoor dat protonen bij elkaar blijven in de kern?  Wat is het atoomnummer van Unununium?
Wat is het atoomnummer van Unununium?
 Internationale analyse verkleint de gevoeligheid van het klimaat voor koolstofdioxide
Internationale analyse verkleint de gevoeligheid van het klimaat voor koolstofdioxide Typen Bobcats
Typen Bobcats  Schade aan versterkte betonnen muren kan groter zijn dan verwacht bij grote aardbeving in Seattle
Schade aan versterkte betonnen muren kan groter zijn dan verwacht bij grote aardbeving in Seattle Wereldwijd grip krijgen op benzinebelastingen
Wereldwijd grip krijgen op benzinebelastingen Waarom kun je niet waarnemen met je zintuigen dat de aardborden bewegen?
Waarom kun je niet waarnemen met je zintuigen dat de aardborden bewegen?
Hoofdlijnen
- Matchmaking met gevolgen
- Nieuwe tool decodeert complexe genomische gegevens van één cel
- Wat kan het binnenoor van een dinosaurus ons vertellen? Luister maar
- Nieuwe aanwijzing gevonden in buitenaardse goudvis suggereert dat het mogelijk een weekdier was
- Zaden in een plant worden gevormd uit de bemesting van eicellen of fruit?
- Wat is een onafhankelijke varibales?
- Als kenmerk van alle levende wezens heeft homeostase het meest direct te maken met welk biologisch thema?
- Waarom noemen wetenschapper membraan een mozaïek?
- De catastrofale vissterfte in Australië:wat is er gebeurd sinds 2019
- Wetenschapper brengt gigantisch virus in kaart

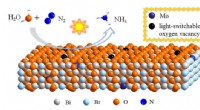
- Verbeterde fotosynthese van ammoniak in de omgeving met behulp van nanosheets met lichtschakelbare zuurstofvacatures
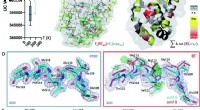
- Fruitcake-structuur waargenomen in organische polymeren

- Wetenschappers ontwikkelen methode om de porositeit van transparante materialen te berekenen

- Het vergelijken van cryogene structuren met monsters op kamertemperatuur kan helpen bij het identificeren van fouten in rekenmodellen
 Hitte en stof helpen Marswater de ruimte in te lanceren, wetenschappers vinden
Hitte en stof helpen Marswater de ruimte in te lanceren, wetenschappers vinden Heeft de test aangetoond dat water bestaat op Mars en de maan?
Heeft de test aangetoond dat water bestaat op Mars en de maan?  Een 3D-geprinte telescoop:de analoge sky drifter
Een 3D-geprinte telescoop:de analoge sky drifter Hoe forensische tandheelkunde werkt
Hoe forensische tandheelkunde werkt  De uitdagingen van een lange ruimtevlucht oplossen met 3D-printen
De uitdagingen van een lange ruimtevlucht oplossen met 3D-printen Drie nieuwe milliseconde pulsars ontdekt in Terzan 5 bolvormige sterrenhoop
Drie nieuwe milliseconde pulsars ontdekt in Terzan 5 bolvormige sterrenhoop Wat is geen voorbeeld van condensatie -kernen?
Wat is geen voorbeeld van condensatie -kernen?  NASA's GPM kijkt naar de regenval van John in de oostelijke Stille Oceaan
NASA's GPM kijkt naar de regenval van John in de oostelijke Stille Oceaan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

