
Wetenschap
Waarom binden natrium- en chloorbinding op de ionische manier?
* elektronegativiteit: Chloor is veel elektronegatief dan natrium, wat betekent dat het een sterkere aantrekkingskracht heeft op elektronen. Dit verschil in elektronegativiteit leidt tot een overdracht van elektronen in plaats van delen.
* Elektronenconfiguratie:
* Natrium heeft één elektron in zijn buitenste schaal (valentie -elektron). Het wil dit elektron verliezen om een stabiele configuratie te bereiken zoals de Noble Gas Neon (NE).
* Chloor heeft zeven elektronen in de buitenste schaal. Het wil één elektron winnen om een stabiele configuratie te bereiken, zoals de Noble Gas Argon (AR).
* Ionische bindingsvorming: Wanneer natrium en chloor op elkaar inwerken, doneert natrium zijn valentie -elektron gemakkelijk aan chloor. Deze overdracht resulteert in:
* natrium (Na+) :Verliest een elektron en wordt een positief geladen ion (kation).
* chloor (Cl-) :Krijgt een elektron en wordt een negatief geladen ion (anion).
* Elektrostatische aantrekkingskracht: De tegengesteld geladen ionen trekken elkaar aan en vormen een ionische binding. Deze sterke elektrostatische kracht houdt de ionen bij elkaar in een kristalroosterstructuur.
Samenvattend komt de ionische binding tussen natrium en chloor voort uit de overdracht van een elektron van natrium naar chloor, aangedreven door hun elektronegativiteitsverschil en de wens om een stabiele elektronenconfiguratie te bereiken.
 Milieu-instanties bezorgd over nieuwe klimaatopmerkingen van Britse regeringen
Milieu-instanties bezorgd over nieuwe klimaatopmerkingen van Britse regeringen Hoe verontreinigende stoffen uit schoorstenen te verwijderen
Hoe verontreinigende stoffen uit schoorstenen te verwijderen  Hoe heeft de samenleving zich aangepast aan orkanen? Een blik op New Orleans meer dan 300 jaar
Hoe heeft de samenleving zich aangepast aan orkanen? Een blik op New Orleans meer dan 300 jaar NASA volgt tyfoon Kalmaegi die Noord-Filippijnen treft
NASA volgt tyfoon Kalmaegi die Noord-Filippijnen treft De wedstrijd voor de ergste luchtverontreinigende stof
De wedstrijd voor de ergste luchtverontreinigende stof
Hoofdlijnen
- Nieuw apparaat zoomt in op microbengedrag op de juiste schaal
- Onderzoek onthult de sleutelrol van de communicatie tussen planten en bacteriën bij de assemblage van een gezond plantenmicrobioom
- Wat is een irisdiafragma in een microscoop?
- Welke transcriptiefactor is hoogstwaarschijnlijk wanneer ze naar beneden gereguleerd worden om oligodendrocieten te veroorzaken die zich niet correct vormen?
- Hoe slaapwandelen werkt
- Wat is oculese?
- Type biologisch middel dat een organisme handelt door het vermogen te overweldigen dat het vermogen zich bevindt, wordt het produceert dat het produceert als een?
- Wat is de wetenschappelijke naam van een herbivoor en een carnivoor?
- Wat je studeert en waar doet er toe, maar dat geldt ook voor het inkomen van je ouders
- Sensoren voor de versheid van voedsel kunnen de houdbaarheidsdatum vervangen om voedselverspilling tegen te gaan
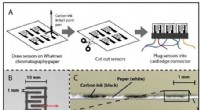
- Legeronderzoekers doen explosieve ontdekking

- Macromoleculaire orde in plastic koninkrijk

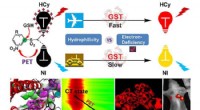
- Elektronendeficiëntie van fluorforen beïnvloedt de herkenningsprestaties van nabij-infrarood fluorescerende sondes
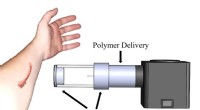
- Spray verven van vezelverbanden op wonden
 Zonneboiler Onderdelen
Zonneboiler Onderdelen  Wat is de term voor wanneer water in de grond en rotsen dringt?
Wat is de term voor wanneer water in de grond en rotsen dringt?  Wat is de apparatuur die wordt gebruikt voor het meten van kracht?
Wat is de apparatuur die wordt gebruikt voor het meten van kracht?  Onderzoeken hoe bryofyten zich aanpassen zonder gibberelline
Onderzoeken hoe bryofyten zich aanpassen zonder gibberelline  Hoe ver zijn meteoroïden weg van de zon?
Hoe ver zijn meteoroïden weg van de zon?  Groenlandse gletsjers:wat eronder ligt
Groenlandse gletsjers:wat eronder ligt  Hoe vindt u de correlatiecoëfficiënt voor R in een spreidingsdiagram
Hoe vindt u de correlatiecoëfficiënt voor R in een spreidingsdiagram Wat voor soort reactie is de vorming van koolmonoxide?
Wat voor soort reactie is de vorming van koolmonoxide?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

