
Wetenschap
Moleculen die geen tegengesteld geladen doelen hebben, zijn welke moleculen?
Dit is waarom:
* polaire moleculen hebben een ongelijke verdeling van elektronen, wat resulteert in een gedeeltelijke positieve lading aan het ene uiteinde van het molecuul en een gedeeltelijke negatieve lading aan de andere kant. Dit creëert een dipoolmoment.
* Niet -polaire moleculen een gelijkmatige verdeling van elektronen hebben. De elektronen worden gelijkelijk gedeeld tussen de atomen, wat resulteert in geen scheiding van lading.
Hier zijn enkele belangrijke kenmerken van niet -polaire moleculen:
* Symmetrische vorm: Niet -polaire moleculen hebben vaak een symmetrische vorm, die bijdraagt aan de gelijkmatige verdeling van elektronen.
* Vergelijkbare elektronegativiteit: De atomen in een niet -polair molecuul hebben vergelijkbare elektronegativiteitswaarden, wat betekent dat ze elektronen gelijk delen.
* Zwakke intermoleculaire krachten: Niet-polaire moleculen hebben zwakkere intermoleculaire krachten (zoals Londense dispersiekrachten) in vergelijking met polaire moleculen, die sterkere krachten hebben zoals dipool-dipoolinteracties en waterstofbinding.
Voorbeelden van niet -polaire moleculen:
* CO2 (koolstofdioxide)
* CH4 (methaan)
* o2 (zuurstof)
* n2 (stikstof)
* H2 (waterstof)
 Kristallen bouwen op een zeer heet oppervlak
Kristallen bouwen op een zeer heet oppervlak Wat zijn de implicaties van uranium?
Wat zijn de implicaties van uranium?  Welke verbinding kan ontleden en magnesiumoxide en water produceren?
Welke verbinding kan ontleden en magnesiumoxide en water produceren?  Als een stof van kleur verandert en van gas afgeeft wanneer verwarmd is, is deze samengesteld?
Als een stof van kleur verandert en van gas afgeeft wanneer verwarmd is, is deze samengesteld?  MOF-cokatalysator maakt selectiviteit van vertakte aldehyden tot 90% mogelijk
MOF-cokatalysator maakt selectiviteit van vertakte aldehyden tot 90% mogelijk
 Het meten van de effecten van waterschaarste op een geïrrigeerde planeet
Het meten van de effecten van waterschaarste op een geïrrigeerde planeet NASA ziet post-tropische storm Teddy zware regen veroorzaken boven Oost-Canada
NASA ziet post-tropische storm Teddy zware regen veroorzaken boven Oost-Canada Duitsland roept crisisbijeenkomst op over Shell Noordzee-platforms
Duitsland roept crisisbijeenkomst op over Shell Noordzee-platforms Voedselzekerheid bedreigd door zeespiegelstijging
Voedselzekerheid bedreigd door zeespiegelstijging Veel Afrikaanse landen overstromen, decennia van ontwikkeling riskeren als ze zich niet aanpassen
Veel Afrikaanse landen overstromen, decennia van ontwikkeling riskeren als ze zich niet aanpassen
Hoofdlijnen
- Een gewone parasiet zou medicijnen naar de hersenen kunnen brengen – hoe wetenschappers Toxoplasma gondii van vijand in vriend veranderen
- Plankton zwemt tegen de stroom in
- Welke schadelijke effecten hebben sommige bacteriën op mensen?
- Wat is een systeem in wetenschappelijke termen?
- Telofase: wat gebeurt er in deze fase van mitose en meiose?
- Welke cellen kunnen worden gezien door het menselijk oog?
- Hoe bekritiseer je iets zonder een eikel te zijn?
- Hoe ga je biologie relateren in de echte situaties?
- Wat is het laagste deel van het menselijk brein?
- Fluorescerend kristal mysterie opgelost
- Fruitig met een vleugje schimmel:hoe schimmelinfecties het aroma van wijn veranderen

- Hoe antilichamen te gebruiken om chemische reacties onder controle te houden?
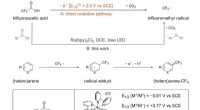
- Trifluorazijnzuur werkt als trifluormethyleringsmiddel bij de functionalisering van areen C-H
- De belangrijkste materialen en apparaten voor intrinsiek flexibele beeldschermen

 Nieuw koolstofnitride-materiaal in combinatie met ruthenium verbetert zichtbaar licht CO2-reductie in water
Nieuw koolstofnitride-materiaal in combinatie met ruthenium verbetert zichtbaar licht CO2-reductie in water Kan nanokoper als smeermiddel worden gebruikt?
Kan nanokoper als smeermiddel worden gebruikt?  Waarom fotografiefans gek zijn op montagevideo van fisheye-lens
Waarom fotografiefans gek zijn op montagevideo van fisheye-lens NASA ziet tropische cycloon 02S zich ontwikkelen in de Zuidelijke Indische Oceaan
NASA ziet tropische cycloon 02S zich ontwikkelen in de Zuidelijke Indische Oceaan Dolfijn uit Florida gevonden met hoogpathogene vogelgriep:rapport
Dolfijn uit Florida gevonden met hoogpathogene vogelgriep:rapport  Hoeveel ATP wordt er vierentwintig uur lang in het menselijk lichaam geproduceerd?
Hoeveel ATP wordt er vierentwintig uur lang in het menselijk lichaam geproduceerd?  Wanneer natriummetaal reageert met ijzerchloride en wordt gevormd?
Wanneer natriummetaal reageert met ijzerchloride en wordt gevormd?  Onderzoekers vinden oudste goudvondst in Zuidwest-Duitsland
Onderzoekers vinden oudste goudvondst in Zuidwest-Duitsland
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

