
Wetenschap
Wat is de relatie tussen oppervlakte en reactiesnelheid?
Dit is waarom:
* meer oppervlakte betekent meer contactpunten: Reacties vinden plaats op het interface tussen reactanten. Een groter oppervlak biedt meer contactpunten tussen de reactanten, waardoor er meer botsingen kunnen plaatsvinden.
* Meer botsingen betekenen een grotere kans op succesvolle reacties: Botsingen zijn essentieel voor chemische reacties. Meer botsingen vergroten de kans dat moleculen de juiste oriëntatie en voldoende energie hebben om te reageren.
Voorbeelden:
* Poedersuiker lost sneller op dan een suikerkubus: Poedersuiker heeft een veel groter oppervlak dan een suikerkubus, waardoor meer contact met watermoleculen en snellere oplossing mogelijk is.
* Houtkoolingen verbranden sneller dan een logboek: Houtkoolingen hebben een groter oppervlak dat wordt blootgesteld aan zuurstof, waardoor snellere verbranding mogelijk is.
* Katalysatoren werken door het oppervlak te vergroten: Veel katalysatoren zijn poreuze materialen met hoge oppervlakken. Dit zorgt ervoor dat meer reactantmoleculen omgaan met de katalysator, waardoor de reactie wordt versneld.
Uitzonderingen:
Hoewel het oppervlak in het algemeen de reactiesnelheid verhoogt, zijn er uitzonderingen:
* reacties beperkt door diffusie: Als de reactanten al in de buurt van de nabijheid zijn, kan het toenemende oppervlak mogelijk niet significant de reactiesnelheid beïnvloeden. Diffusie kan in dergelijke gevallen de beperkende factor zijn.
* reacties met meerdere stappen: De snelheid van een multi-step-reactie kan worden geregeld door een stap die niet wordt beïnvloed door het oppervlak.
Over het algemeen is het begrijpen van de relatie tussen oppervlakte- en reactiesnelheid cruciaal voor het optimaliseren van de reactieomstandigheden, het ontwerpen van efficiënte katalysatoren en het voorspellen van reactieresultaten.
 Hoe verwijdert de herkristallisatie oplosmiddel oplosbare onzuiverheden?
Hoe verwijdert de herkristallisatie oplosmiddel oplosbare onzuiverheden?  Bij 115 graden verandert zwavel in A?
Bij 115 graden verandert zwavel in A?  Wat gebeurt er als NaCl en HCl aan water worden toegevoegd?
Wat gebeurt er als NaCl en HCl aan water worden toegevoegd?  Hoe nieuwe stoffen ontstaan
Hoe nieuwe stoffen ontstaan  Nadat ze gemengde chemicaliën zijn voor filmontwikkeling, moeten een onmiddellijk worden gebruikt B bewaard in luchtdichte containers C onbedekte metalen pannen?
Nadat ze gemengde chemicaliën zijn voor filmontwikkeling, moeten een onmiddellijk worden gebruikt B bewaard in luchtdichte containers C onbedekte metalen pannen?
 Tropische cycloon of ISU-cycloon? Semantische wetenschappelijke zoekmachine weet dat er een verschil is
Tropische cycloon of ISU-cycloon? Semantische wetenschappelijke zoekmachine weet dat er een verschil is  Welke vooringenomenheid is er een wetenschappelijk experiment?
Welke vooringenomenheid is er een wetenschappelijk experiment?  Bodemsediment onthult dat klimaatverandering in meren stroomt
Bodemsediment onthult dat klimaatverandering in meren stroomt Knaagdieren van Arizona
Knaagdieren van Arizona  Hoe kunt u uw kennis van elektronegativiteit in het echte leven toepassen?
Hoe kunt u uw kennis van elektronegativiteit in het echte leven toepassen?
Hoofdlijnen
- Is Mitochondrion een deelnemer aan fotosynthese?
- Mitzi en de gigantische haarbal
- Wat is de term hypothesen?
- Waarom verandert de vervanging van nucleotiden in muis zijn fysieke kenmerken?
- Welke bio -moleculen zitten in een ribosomen?
- Wat is de implicatie van de wetenschap?
- Wat is de juiste bacteriën van de maïsmuisbacteriën?
- Nieuwe studie werpt licht op de rol van de zon bij het verminderen van schimmelziekte van mangofruit
- Onderzoek biedt belangrijk inzicht in hoe cellen fuseren
- Chemici tonen aan dat het katalytische bereik van enzymen kan worden vergroot
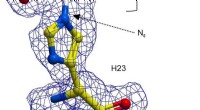
- Een groene katalysator voor farmaceutische en industriële chemie
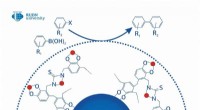
- Speciale eiwitrijke planten zorgen voor eiwitten, vezels en antioxidanten in één verpakking

- Kleurcodering moleculaire spiegelbeelden
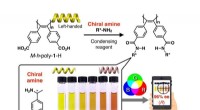
- Studie ontrafelt het mysterie van antimicrobiële kikkersecreties

 Dit is waarom je Apple Watch je vertelt om de hele tijd te ademen
Dit is waarom je Apple Watch je vertelt om de hele tijd te ademen Wat zijn toepassingen in een wetenschapsproject?
Wat zijn toepassingen in een wetenschapsproject?  Schrijf de evenwichtige vergelijking voor verbranding in de lucht van Dodecane?
Schrijf de evenwichtige vergelijking voor verbranding in de lucht van Dodecane?  Levenscyclus van een geverfde Dame Butterfly
Levenscyclus van een geverfde Dame Butterfly Verschillende methoden voor afvalverwijdering
Verschillende methoden voor afvalverwijdering Wat verbruikt de meeste elektriciteit in een huis?
Wat verbruikt de meeste elektriciteit in een huis?  Wat is wetenschap en zijn voorbeelden?
Wat is wetenschap en zijn voorbeelden?  Verbeteren van asfaltwegverharding met behulp van kunstmatige nano-mineraalcomposieten
Verbeteren van asfaltwegverharding met behulp van kunstmatige nano-mineraalcomposieten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

