
Wetenschap
Hoe verhoudt de kinetische theorie van materie zich tot vloeistoffen en gassen van vaste stoffen?
vaste stoffen:
* deeltjesopstelling: Deeltjes in vaste stoffen zijn strak verpakt en gerangschikt in een sterk geordende, kristallijne structuur.
* beweging: Deeltjes in vaste stoffen trillen over vaste posities. Ze hebben een zeer beperkte translationele beweging (beweging van de ene plaats naar de andere).
* krachten: Sterke intermoleculaire krachten houden de deeltjes bij elkaar, wat resulteert in een vaste vorm en volume.
* Kinetische energie: Vaste stoffen hebben de laagste kinetische energie van de drie staten van materie.
vloeistoffen:
* deeltjesopstelling: Deeltjes in vloeistoffen zijn dichter bij elkaar dan in gassen, maar hebben minder orde dan in vaste stoffen.
* beweging: Deeltjes in vloeistoffen kunnen zich verplaatsen, langs elkaar glijden en een grotere mate van translationele beweging hebben dan vaste stoffen.
* krachten: Intermoleculaire krachten zijn zwakker dan in vaste stoffen, waardoor vloeistoffen kunnen stromen en de vorm van hun container kunnen aannemen.
* Kinetische energie: Vloeistoffen hebben hogere kinetische energie dan vaste stoffen, waardoor deeltjes sommige intermoleculaire krachten kunnen overwinnen en vrij kunnen bewegen.
gassen:
* deeltjesopstelling: Deeltjes in gassen zijn breed op afstand en hebben geen regelmatige opstelling.
* beweging: Deeltjes in gassen bewegen snel en willekeurig en vertonen een hoge translationele beweging. Ze botsen met elkaar en de muren van hun container.
* krachten: Intermoleculaire krachten zijn erg zwak in gassen, wat resulteert in geen vaste vorm of volume.
* Kinetische energie: Gassen hebben de hoogste kinetische energie van de drie toestanden van materie, waardoor deeltjes intermoleculaire krachten kunnen overwinnen en vrij kunnen bewegen.
Belangrijke relaties:
* Temperatuur: De kinetische theorie legt uit dat de gemiddelde kinetische energie van deeltjes recht evenredig is met de absolute temperatuur. Dit betekent dat warme stoffen sneller bewegende deeltjes hebben.
* Druk: In gassen is druk het gevolg van botsingen tussen gasdeeltjes en de containerwanden. Hogere kinetische energie (en dus hogere temperatuur) leidt tot frequentere en krachtige botsingen, wat resulteert in een hogere druk.
* Faseveranderingen: De kinetische theorie legt uit hoe veranderingen in temperatuur de toestand van materie beïnvloeden. Verhogende temperatuur verhoogt de kinetische energie, die intermoleculaire krachten kan overwinnen, wat leidt tot faseveranderingen van vaste tot vloeistof (smelten) of vloeistof naar gas (koken).
Samenvattend biedt de kinetische theorie van materie een fundamenteel kader voor het begrijpen van de verschillen in de fysieke eigenschappen van vaste stoffen, vloeistoffen en gassen op basis van de beweging en interacties van hun samenstellende deeltjes.
 Na een grote aardbeving, naschokken blijven Alaska rammelen
Na een grote aardbeving, naschokken blijven Alaska rammelen Wat zou een zonnestelsel of melkweg- en microscopisch ecosysteem gemeen kunnen hebben?
Wat zou een zonnestelsel of melkweg- en microscopisch ecosysteem gemeen kunnen hebben?  Geven bomen de ene keer zuurstof af en de andere keer koolstofdioxide?
Geven bomen de ene keer zuurstof af en de andere keer koolstofdioxide?  NASA's Aqua-satelliet volgt tropische cycloon Lorna
NASA's Aqua-satelliet volgt tropische cycloon Lorna Opkomende niveaus van organische verontreinigingen die sterk worden beïnvloed door stroomstromen, seizoenen
Opkomende niveaus van organische verontreinigingen die sterk worden beïnvloed door stroomstromen, seizoenen
Hoofdlijnen
- Welke cel wordt waargenomen als A de vorming van een contractiele ring vertoont net voorafgaand aan cytoplasmatische divisie?
- Waarom reageren moleculen van glucosegalactose en fructose anders tijdens het metabolisme?
- Hoe cellen omgaan met gebroken chromosomen
- Wetenschappers ontdekken methode om voedselverspilling om te zetten in biobrandstoffen
- Een gemakkelijke manier om het skelet te onthouden
- Wat zijn de opslagkamers binnen de cel?
- Hoe de gezondheid van honingbijenkorven het milieubeleid in Canadese steden kan beïnvloeden
- Studie ontdekt dat cellulaire activiteit die erop wijst dat recycling in ons DNA zit
- Welke technologie gebruiken milieuwetenschappers om de beweging van ijsberen en andere kwetsbare populaties te volgen?
- Het wateroppervlak is een fantastische plek voor chemische reacties

- Dennennaalden van oude kerstbomen kunnen in de toekomst worden omgezet in verf en voedselzoetstoffen

- Chemici kenmerken de dodelijke schimmel onder ons
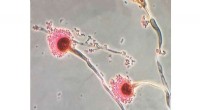
- Een goede zaak beter maken:een zuurtest die niet in water verdrinkt
- Boomringen gebruikt om smokkelaarsringen tegen te gaan

 Hoe te berekenen volume van gebied
Hoe te berekenen volume van gebied  Waarom missen planten de mobiele fagocytische cellen die typerend zijn voor dierlijke cellen?
Waarom missen planten de mobiele fagocytische cellen die typerend zijn voor dierlijke cellen?  Ontgrendel uw liefde met een Tarot-relatiespreiding
Ontgrendel uw liefde met een Tarot-relatiespreiding  Wetenschappers creëren bio-geïnspireerde, breed regelbare ultradunne optische componenten
Wetenschappers creëren bio-geïnspireerde, breed regelbare ultradunne optische componenten Studie onderzoekt de voordelen van neurodiversiteit op de werkplek
Studie onderzoekt de voordelen van neurodiversiteit op de werkplek Niet-vasculaire plant: definitie, kenmerken, voordelen en voorbeelden
Niet-vasculaire plant: definitie, kenmerken, voordelen en voorbeelden  Hoe speelt de wetenschap een rol in je alledaagse?
Hoe speelt de wetenschap een rol in je alledaagse?  Wat zijn de toepassingen van woestijngrond?
Wat zijn de toepassingen van woestijngrond?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

