
Wetenschap
Wat heeft een hoger kookpunt CH3CH3 of CH3CL?
Dit is waarom:
* intermoleculaire krachten: De sterkte van intermoleculaire krachten tussen moleculen bepaalt hun kookpunt. Sterkere intermoleculaire krachten vereisen meer energie om te overwinnen, wat leidt tot een hoger kookpunt.
* Dipole-dipole interacties: CH3CL is een polair molecuul vanwege het elektronegativiteitsverschil tussen chloor en koolstof. Dit creëert een permanent dipoolmoment, waardoor dipool-dipool interacties tussen moleculen mogelijk zijn, die sterker zijn dan de London-dispersiekrachten die aanwezig zijn in het niet-polaire ethaan (CH3CH3).
* Dispersietroepen in Londen: Hoewel beide moleculen de dispersiekrachten van Londen vertonen, zijn deze krachten zwakker in ethaan vanwege de kleinere omvang en minder polariseerbaarheid.
Samenvattend: De sterkere dipool-dipoolinteracties in CH3CL, vergeleken met de zwakkere dispersiekrachten in Londen in CH3CH3, resulteren in een hoger kookpunt voor chloormethaan.
 Wat is de chemische formule en lading van waterstoffosfaation?
Wat is de chemische formule en lading van waterstoffosfaation?  Wat kan er gezegd worden over de reactie bij 500K?
Wat kan er gezegd worden over de reactie bij 500K?  Wat is de formulemassa van S2Cl2?
Wat is de formulemassa van S2Cl2?  Wanneer zoutzuur en magnesiumcarbonaat reageren, wat produceren ze?
Wanneer zoutzuur en magnesiumcarbonaat reageren, wat produceren ze?  Hoe laten chemische fabrikanten de reactie doorgaan met ammoniak ooit een evenwicht heeft bereikt?
Hoe laten chemische fabrikanten de reactie doorgaan met ammoniak ooit een evenwicht heeft bereikt?
 Nationale parken een boost voor de geestelijke gezondheid ter waarde van biljoenen:studie
Nationale parken een boost voor de geestelijke gezondheid ter waarde van biljoenen:studie Wetenschappers werpen nieuw licht op de rol van virussen bij koraalverbleking
Wetenschappers werpen nieuw licht op de rol van virussen bij koraalverbleking Halve marathon Delhi gaat ondanks smog door rechtbank regels
Halve marathon Delhi gaat ondanks smog door rechtbank regels Wat is een manier waarop de pioniers de omgeving hebben beïnvloed?
Wat is een manier waarop de pioniers de omgeving hebben beïnvloed?  NASA vindt windschering die orkaan Kenneth . verzwakt
NASA vindt windschering die orkaan Kenneth . verzwakt
Hoofdlijnen
- Onderzoekers ontdekken details over hoe bacteriën beschermende barrières bouwen, wat nieuwe antibiotica kan opleveren
- Dinosaurussen:jong, volwassen of senior?
- Wat wordt bewaard in Gene Bank?
- Zullen grote ambities op het gebied van biodiversiteit voldoende zijn om de natuur te redden?
- Welke structuren hebben plantencellen dat dier zijn hun functies?
- Waarom wordt de masterklier zo genoemd?
- Welke gevolgen zou het weggooien van afval enz. voor het levende organisme hebben?
- Nieuwe atlas biedt ongekende inzichten over hoe genen functioneren in de vroege embryo-ontwikkeling
- Welke vier dingen doen levende wezens?
- Pigmenten in olieverfschilderijen in verband met degradatie van kunstwerken

- Moleculair dunne interface tussen polymeren voor efficiënt koolstofdioxide-opvangmembraan

- Chemische sondes maken de weg vrij voor een beter begrip van de ontwikkeling van ziekten
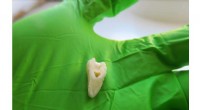
- Super sterk, biocompatibel materiaal kan kapotte vullingen tot het verleden maken
- Wetenschappers ontdekken stabiliteit in hybride foto-elektrische nanomaterialen

 Hoeveel kracht genereert een windturbine?
Hoeveel kracht genereert een windturbine?  Hoe vergelijk ik 4140 & 4150 staal?
Hoe vergelijk ik 4140 & 4150 staal?  De waarde van de natuur moet worden opgenomen in de economie om de biodiversiteit te behouden
De waarde van de natuur moet worden opgenomen in de economie om de biodiversiteit te behouden Wie heeft de Spritzer Space Telescope uitgevonden?
Wie heeft de Spritzer Space Telescope uitgevonden?  Hoe werken lithium-ionbatterijen?
Hoe werken lithium-ionbatterijen? Hydraulisch breken heeft een negatieve invloed op de gezondheid van baby's
Hydraulisch breken heeft een negatieve invloed op de gezondheid van baby's Wat hebben planten en dieren nodig om te kunnen groeien?
Wat hebben planten en dieren nodig om te kunnen groeien?  Bio-nanocellulose meshes verbeteren herniaherstelchirurgie
Bio-nanocellulose meshes verbeteren herniaherstelchirurgie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

