
Wetenschap
Wat is een ongelijke verdeling van geladen in atoom?
Hier is een uitsplitsing:
* atomen zijn neutraal: Atomen hebben een gelijk aantal protonen (positieve lading) en elektronen (negatieve lading), waardoor ze in het algemeen elektrisch neutraal zijn.
* Elektronen zijn niet gelijk verdeeld: Hoewel het atoom neutraal is, zijn de elektronen niet altijd gelijk verdeeld over de kern. Dit komt door de verschillende elektronegativiteiten van atomen in een molecuul.
* elektronegativiteit: Elektronegativiteit is het vermogen van een atoom om elektronen in een binding aan te trekken. Meer elektronegatieve atomen trekken de elektronen dichter bij hen, waardoor een gedeeltelijke negatieve lading ontstaat op dat atoom en een gedeeltelijke positieve lading op het minder elektronegatieve atoom.
* Dipoolmoment: Deze ongelijke ladingsverdeling creëert een dipoolmoment , een maat voor de scheiding van positieve en negatieve ladingen binnen een molecuul.
* Polaire moleculen: Moleculen met significante dipoolmomenten worden polaire moleculen genoemd . Ze hebben een "positief einde" en een "negatief einde" vanwege de ongelijke ladingsverdeling.
Voorbeelden:
* water (h₂o): Zuurstof is elektronegatiefer dan waterstof, dus de elektronen in de O-H-bindingen besteden meer tijd dichter bij het zuurstofatoom. Dit creëert een gedeeltelijke negatieve lading op de zuurstof- en gedeeltelijke positieve ladingen op de hydrogenen.
* koolstofdioxide (co₂): De zuurstofatomen zijn meer elektronegatief dan het koolstofatoom. Omdat het molecuul echter lineair is, annuleren de dipoolmomenten van de twee C-O-bindingen elkaar, wat resulteert in een nonpolar molecuul.
Inzicht in dipoolmomenten is belangrijk omdat het ons helpt het gedrag van moleculen te voorspellen, zoals hun oplosbaarheid in verschillende oplosmiddelen en hun vermogen om te interageren met andere moleculen.
 Hoe zou de concentratie van ozonmoleculen veranderen als de zuurstof afnam?
Hoe zou de concentratie van ozonmoleculen veranderen als de zuurstof afnam?  Wat zijn monochloreringsproducten?
Wat zijn monochloreringsproducten?  Gebruik van zonlicht om de toekomst te voeden via covalente organische raamwerken
Gebruik van zonlicht om de toekomst te voeden via covalente organische raamwerken Wetenschappers ontwikkelen een nieuwe methode om de efficiëntie van luchtreinigers te verbeteren
Wetenschappers ontwikkelen een nieuwe methode om de efficiëntie van luchtreinigers te verbeteren Wat moet hetzelfde zijn om te bepalen of twee atomen koper zijn?
Wat moet hetzelfde zijn om te bepalen of twee atomen koper zijn?
 Afdelingen van het plantenrijk
Afdelingen van het plantenrijk  Vulkaanuitbarstingen hadden het afgelopen millennium grote en aanhoudende gevolgen voor het wereldwijde hydroklimaat
Vulkaanuitbarstingen hadden het afgelopen millennium grote en aanhoudende gevolgen voor het wereldwijde hydroklimaat Hoe verklaart het idee van atomen het behoud van de priciënetel?
Hoe verklaart het idee van atomen het behoud van de priciënetel?  De impact van de bodemmicrobiota op de mitigatie van broeikasgassen in tropische bossen
De impact van de bodemmicrobiota op de mitigatie van broeikasgassen in tropische bossen Wat hoveniers kunnen leren van de wedergeboorte van de natuur na brand
Wat hoveniers kunnen leren van de wedergeboorte van de natuur na brand
Hoofdlijnen
- Windparken langs bergruggen kunnen vleermuizen negatief beïnvloeden
- Welk lichaamsgedeelte is de breadbasket?
- Fibrine wordt geproduceerd wanneer de bloedcomponenten worden genoemd wat een kettingreactie starten die stolsel produceert?
- Wat zijn verschillende functies van wortels in planten?
- Beschrijf soorten hersenen met diagram?
- Als één cel zes keer verdeelt, hoeveel cellen zullen produseren?
- Chemische vingerafdrukken gebruiken om fraude met zeevruchten en illegale visserij te bestrijden
- Welk onderwerp wordt de vader van alle wetenschappen genoemd?
- De twee of meer gerelateerde genen die een eigenschap regelen, staan bekend als?
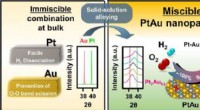
- Directe synthese van waterstofperoxide met een platina-gouden nanodeeltjeskatalysator
- Nieuwe methaanconcentratietechnologieën voor monitoring van broeikasgasemissies

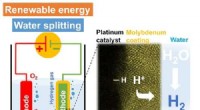
- Coating van molybdeen verbetert de efficiëntie van katalysatoren voor de productie van waterstof
- Meer zien met PET-scans:verrassend nieuw mechanisme voor bevestiging van chemische tracers ontdekt
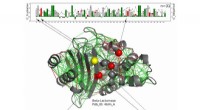
- Werkende eiwitten maken goed gebruik van frustratie
 Hoe het brein leert zien
Hoe het brein leert zien  Bedrijven zijn terughoudend om extra te betalen om duurzaamheidsclaims van leveranciers te bevestigen
Bedrijven zijn terughoudend om extra te betalen om duurzaamheidsclaims van leveranciers te bevestigen  Hoe koude hitte werkt
Hoe koude hitte werkt  Wat is 41 graden C in F?
Wat is 41 graden C in F?  Math legt uit waarom je busroute zo onbetrouwbaar lijkt
Math legt uit waarom je busroute zo onbetrouwbaar lijkt  Wat heeft deze spookachtige sporen in de lucht achtergelaten?
Wat heeft deze spookachtige sporen in de lucht achtergelaten?  Wat is 1064 graden Celsius in Fahrenheit?
Wat is 1064 graden Celsius in Fahrenheit?  Wat kunt u afleiden uit het bestuderen van de diepten en diameters van kraters op de maan?
Wat kunt u afleiden uit het bestuderen van de diepten en diameters van kraters op de maan?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

