
Wetenschap
Hoe verandert de beweging van watermoleculen wanneer vloeistof naar gas wordt gevormd?
in de vloeibare toestand:
* Nabijheid sluiten: Watermoleculen zijn relatief dicht bij elkaar, vastgehouden door zwakke waterstofbruggen.
* Matige beweging: De moleculen hebben voldoende energie om te trillen en te bewegen, maar ze worden nog steeds beperkt door de bindingen. Dit is de reden waarom vloeistoffen een duidelijk volume hebben, maar van vorm kunnen veranderen.
* constante botsingen: Watermoleculen botsen elkaar constant tegen.
De overgang naar gas (verdamping/koken):
* Energie -input: Warmte -energie wordt toegevoegd aan het vloeibare water. Deze energie verhoogt de kinetische energie (energie van beweging) van de watermoleculen.
* Breaking Bonds: Naarmate de moleculen energie krijgen, trillen ze sneller en overwinnen ze de aantrekkelijke krachten die ze bij elkaar houden. De waterstofbindingen breken.
* Verhoogde afstand: De watermoleculen worden energieker en gaan verder uit elkaar.
* Vrijheid van beweging: De moleculen hebben nu voldoende energie om aan het oppervlak van de vloeistof te ontsnappen en vrij in alle richtingen te bewegen, worden een gas (waterdamp).
In de gasstatus:
* brede afstand: Gasmoleculen liggen veel verder uit elkaar dan in de vloeibare toestand.
* snelle en willekeurige beweging: Ze bewegen snel in alle richtingen, botsen met elkaar en de containerwanden.
* Geen bepaald volume: Omdat ze zo breed op elkaar staan, kunnen gassen uitbreiden om elke container te vullen.
Key Concepts:
* Kinetische energie: De energie van beweging. Meer kinetische energie betekent snellere beweging.
* Waterstofbindingen: Zwakke attracties tussen watermoleculen. Deze bindingen worden verbroken wanneer water overgaat naar een gas.
* Temperatuur: Een maat voor de gemiddelde kinetische energie van de moleculen in een stof. Hogere temperatuur betekent meer kinetische energie.
Laat het me weten als je meer details wilt over een specifiek aspect van dit proces!
 Monash-ingenieurs verbeteren de vermoeiingslevensduur van aluminiumlegeringen met hoge sterkte met 25 keer
Monash-ingenieurs verbeteren de vermoeiingslevensduur van aluminiumlegeringen met hoge sterkte met 25 keer Wanneer een lood(II)nitraatoplossing wordt toegevoegd aan kaliumjodide, ontstaat er een vaste vorm en blijft dit achter.
Wanneer een lood(II)nitraatoplossing wordt toegevoegd aan kaliumjodide, ontstaat er een vaste vorm en blijft dit achter.  Wat gebeurt er met een atoom met een kern die buiten de band van stabiliteit valt?
Wat gebeurt er met een atoom met een kern die buiten de band van stabiliteit valt?  Hoe Redox-vergelijkingen in evenwicht te brengen
Hoe Redox-vergelijkingen in evenwicht te brengen Welk voorbeeld waar materialen als vloeistoffen worden bereid om het gemakkelijker te maken?
Welk voorbeeld waar materialen als vloeistoffen worden bereid om het gemakkelijker te maken?
 Diepe neurale netwerken versnellen weer- en klimaatmodellen
Diepe neurale netwerken versnellen weer- en klimaatmodellen Wat betekent terugkeer van de aarde?
Wat betekent terugkeer van de aarde?  Wat veroorzaakt aardbevingen in het noordoosten, zoals de magnitude 4,8 die New Jersey deed schudden? Een geowetenschapper legt het uit
Wat veroorzaakt aardbevingen in het noordoosten, zoals de magnitude 4,8 die New Jersey deed schudden? Een geowetenschapper legt het uit  Hoe zal de wereldgemeenschap reageren als kwetsbare landen pionieren met geo-engineering op het gebied van zonnestraling?
Hoe zal de wereldgemeenschap reageren als kwetsbare landen pionieren met geo-engineering op het gebied van zonnestraling? Amazon vuurt een omslagpunt af:chef bosbouwgroep
Amazon vuurt een omslagpunt af:chef bosbouwgroep
Hoofdlijnen
- Wat is de term die wordt gebruikt voor het aantal chromosomen dat in een cel wordt gevonden?
- Nieuw machine learning-systeem kan automatisch vormen van rode bloedcellen identificeren
- Wat is een subarachnoïdale bloeding?
- Welk type matrix vertoont Adipose Tissue?
- Continentale controles nodig om de strijd tegen boomziekten te handhaven
- Het feit dat een nakomelingen niet identiek zijn, staat bekend als?
- Wat is het wetenschappelijke woord voor seks?
- Hoe hiv bevestigd met gastheercel?
- Onderzoekers ontwikkelen CRISPR om enkele RNA-letters in menselijke cellen te bewerken
- Een moleculaire blik op ontluikende HDL-vorming

- Verbetering van het elektromechanische gedrag van een flexibel polymeer

- Biostasis heeft tot doel de dood na traumatisch letsel te voorkomen door biochemische reacties in cellen te vertragen

- Hoe kleine enzymen de overhand hebben in wereldwijde koolstofrecycling

- Wetenschappers identificeren atomaire structuur van katalytisch actieve koper-ceriumoxide-interface
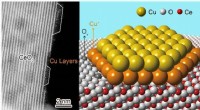
 Is er een andere energietoestand afgezien van de laagste voor een elektron?
Is er een andere energietoestand afgezien van de laagste voor een elektron?  Eerstejaars scheikunde gooit het leerboek weg
Eerstejaars scheikunde gooit het leerboek weg Wat is de uitgebalanceerde vergelijking van aluminiumnitraat plus natriumfosfaat?
Wat is de uitgebalanceerde vergelijking van aluminiumnitraat plus natriumfosfaat?  Vijf dingen die u moet weten over NASA's Deep Space Atomic Clock
Vijf dingen die u moet weten over NASA's Deep Space Atomic Clock Bacterieel model helpt onthullen hoe ons lichaam bevolkingsexplosies – en kanker – voorkomt
Bacterieel model helpt onthullen hoe ons lichaam bevolkingsexplosies – en kanker – voorkomt  Wat is verantwoordelijk voor de voortdurende verhoging van vele grote bergketens?
Wat is verantwoordelijk voor de voortdurende verhoging van vele grote bergketens?  Wat zijn wolkbreuken en zorgt de klimaatverandering ervoor dat ze vaker voorkomen?
Wat zijn wolkbreuken en zorgt de klimaatverandering ervoor dat ze vaker voorkomen?  Welke van uw vijf zintuigen begrijpen wetenschappers het minst goed?
Welke van uw vijf zintuigen begrijpen wetenschappers het minst goed?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

