
Wetenschap
Verenigen chemische reacties die de entropie verhogen, spontaan op zich?
Dit is waarom:
* Entropie (s): Een maat voor wanorde of willekeur in een systeem.
* Spontane reacties: Reacties die optreden zonder externe invoer van energie.
* Gibbs Free Energy (G): Een thermodynamisch potentieel dat enthalpie (H, een maat voor energie) en entropie (s) combineert om de spontaniteit van een reactie te voorspellen. De vergelijking is: ΔG =ΔH - Tδs , waar T temperatuur is.
Sleutelpunten:
* Positieve entropiewijziging (ΔS> 0): Wanneer een reactie de stoornis verhoogt (meer producten, meer gasmoleculen, enz.), Is de entropieverandering positief.
* Negatieve Gibbs vrije energieverandering (ΔG <0): Spontane reacties hebben een negatieve Gibbs vrije energieverandering, wat betekent dat ze vrije energie afgeven.
* Relatie tussen entropie en spontaniteit: Een positieve entropieverandering draagt bij aan een negatieve Gibbs -vrije energieverandering, waardoor de reactie waarschijnlijk spontaan zal voorkomen.
Voorbeeld:
* De verbranding van methaan (CH4) in koolstofdioxide (CO2) en water (H2O) is spontaan omdat het de entropie verhoogt. De reactanten zijn een enkel molecuul van methaan, terwijl de producten meerdere moleculen van CO2 en H2O omvatten, wat resulteert in een grotere aandoening.
Belangrijke opmerking:
Hoewel een toename van de entropie -gunsten spontaniteit is, is dit niet de enige factor. De enthalpie -verandering (ΔH) speelt ook een rol:
* exotherme reacties (ΔH <0): Deze reacties geven warmte vrij, waardoor ze eerder spontaan zijn.
* Endothermische reacties (ΔH> 0): Deze reacties absorberen warmte, waardoor ze minder snel spontaan zijn.
Samenvattend:
Chemische reacties die de entropie verhogen, komen vaak spontaan op, maar de algehele spontaniteit wordt bepaald door de balans tussen entropie en enthalpieveranderingen.
 Welke vloeistoffen koken bij een lagere gastemperatuur dan water?
Welke vloeistoffen koken bij een lagere gastemperatuur dan water?  Koud sinteren produceert condensatormateriaal bij record lage temperaturen
Koud sinteren produceert condensatormateriaal bij record lage temperaturen Wat is een colaventbinding?
Wat is een colaventbinding?  Geef een voorbeeld van ondoorzichtige materialen?
Geef een voorbeeld van ondoorzichtige materialen?  Als x een element van groep 1 vertegenwoordigt, zou de formule het oxide zijn wat?
Als x een element van groep 1 vertegenwoordigt, zou de formule het oxide zijn wat?
 Wat doen milieuwetenschappers?
Wat doen milieuwetenschappers?  Carbon Footprint Wood Pellets Vs. hout
Carbon Footprint Wood Pellets Vs. hout  Welke functie hebben planten in de koolstofcyclus van bossen?
Welke functie hebben planten in de koolstofcyclus van bossen?  Zomerse snikhete trend:West krijgt warmere dagen, Oost hete nachten
Zomerse snikhete trend:West krijgt warmere dagen, Oost hete nachten Mensen betalen om hun bomen niet te kappen kan een kosteneffectieve manier zijn om de CO2-uitstoot te verminderen, studie toont
Mensen betalen om hun bomen niet te kappen kan een kosteneffectieve manier zijn om de CO2-uitstoot te verminderen, studie toont
Hoofdlijnen
- Waar is een protistische celwand van gemaakt?
- Welke organellen zitten er in een hondencel?
- Feiten over Prokaryotic
- Wat als mensen als vogels waren geëvolueerd?
- Welke methode zou u gebruiken om organismen te verdelen in groepenklassen op basis van specifieke kenmerken?
- Wat belangrijk is bij het maken van melk:Uit onderzoek blijkt dat foetale seks de melkproductie kan beïnvloeden
- 195 manieren om de geschilderde dames van Californië te helpen:nieuwe voedselbronnen bieden hoop voor bedreigde vlinders
- De tertiaire structuur van een eiwit is de?
- 7 soorten bindweefsel
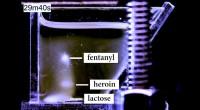
- In gloeiende kleuren:de verspreiding van medicijndeeltjes in een forensisch laboratorium zien

- Laboratoriumtechnologie biedt duidelijkheid te midden van zorgen over waterverontreiniging in Hawaï

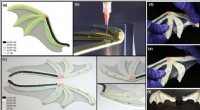
- Meerlagige fabricage op wafelschaal van micro-elektronica op basis van zijdefibroïne

- Onderzoekers breken nieuwe wegen in 3D-geprinte zachte robotica met het grootste assortiment polymeerhybriden
- Nieuwe technologie kan wetshandhavers helpen kleinere hoeveelheden fentanyl met een hogere mate van nauwkeurigheid te detecteren
 Is het de moeite waard om kalksteen te winnen vanwege de vervuiling?
Is het de moeite waard om kalksteen te winnen vanwege de vervuiling?  Feiten over de menselijke schedel voor kinderen
Feiten over de menselijke schedel voor kinderen Welke satellieten gingen in welk jaar naar Venus?
Welke satellieten gingen in welk jaar naar Venus?  Diagnose van kunstacne in Georgia OKeeffes-schilderijen
Diagnose van kunstacne in Georgia OKeeffes-schilderijen Binaural Beats:kalmeert deze auditieve illusie je hersenen echt?
Binaural Beats:kalmeert deze auditieve illusie je hersenen echt?  Welke stralen hebben meer energie -bèta of gammastralen?
Welke stralen hebben meer energie -bèta of gammastralen?  Mentorprogramma's helpen vrouwelijke economen tenure-trackposities te bemachtigen
Mentorprogramma's helpen vrouwelijke economen tenure-trackposities te bemachtigen Wat zijn voorbeelden van moleculaire stoffen?
Wat zijn voorbeelden van moleculaire stoffen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

