
Wetenschap
Welke verbinding is meer polair en oplosbaar in watermethaan of methanol waarom?
Dit is waarom:
* polariteit:
* methanol Heeft een polaire O-H-binding, die een gedeeltelijke positieve lading creëert op het waterstofatoom en een gedeeltelijke negatieve lading op het zuurstofatoom. Dit maakt methanol een polair molecuul.
* methaan heeft alleen C-H-obligaties, die niet-polair zijn. Alle bindingen zijn symmetrisch, dus het molecuul zelf is niet -polair.
* Oplosbaarheid in water:
* Water (H2O) is een zeer polair molecuul. Het vormt waterstofbindingen met andere watermoleculen.
* methanol kunnen waterstofbruggen vormen met watermoleculen vanwege zijn polaire O-H-binding. Met deze sterke interactie kan methanol goed oplossen in water.
* methaan , niet -polair zijn, kan geen waterstofbruggen met water vormen. Het ervaart alleen zwakke Van der Waals krachten met watermoleculen, waardoor het praktisch onoplosbaar is in water.
Samenvattend:
De polariteit van Methanol als gevolg van de O-H-binding maakt het in staat om waterstofbruggen met water te vormen, wat resulteert in een hoge oplosbaarheid. Methaan, niet -polair, kan deze sterke interacties met water niet vormen, waardoor het onoplosbaar wordt.
 Op weg naar platina:een niet-giftige katalysator voor schoon, herbruikbaar water
Op weg naar platina:een niet-giftige katalysator voor schoon, herbruikbaar water De chemische eigenschappen van een atoom worden bepaald door zijn atomaire?
De chemische eigenschappen van een atoom worden bepaald door zijn atomaire?  Spierachtig materiaal zet uit en trekt samen als reactie op licht
Spierachtig materiaal zet uit en trekt samen als reactie op licht Waarom moet het aantal atomen elk element hetzelfde blijven in een chemische vergelijking?
Waarom moet het aantal atomen elk element hetzelfde blijven in een chemische vergelijking?  Welk gas wordt geproduceerd wanneer kaliumhydroxide en calciumcarbonaat worden gemengd?
Welk gas wordt geproduceerd wanneer kaliumhydroxide en calciumcarbonaat worden gemengd?
 Wat zijn twee manieren waarop wetenschappers de klimaatgeschiedenis van de aarde kunnen bestuderen?
Wat zijn twee manieren waarop wetenschappers de klimaatgeschiedenis van de aarde kunnen bestuderen?  Hoe kunnen planten een hernieuwbare bron zijn?
Hoe kunnen planten een hernieuwbare bron zijn?  Hoe klimaat en waterbeheer de seizoensinvloeden van de stroom beïnvloeden
Hoe klimaat en waterbeheer de seizoensinvloeden van de stroom beïnvloeden  Afbeelding:Onder de middernachtzon
Afbeelding:Onder de middernachtzon Wetenschappers gaan op ontdekkingstocht naar nieuw Antarctisch ecosysteem
Wetenschappers gaan op ontdekkingstocht naar nieuw Antarctisch ecosysteem
Hoofdlijnen
- Wat zijn de voorouders van Cactus?
- Wat zijn de kenmerken van chloroplasten?
- Drie voorbeelden van protisten met wetenschappelijke namen
- Bij mensen welke van deze is vereist voor het dragen van zuurstof van de longen naar lichaamscellen?
- Studie onthult onderliggende genetische basis voor communicatie en sociaal gedrag van halictidebijen
- Welk type basisbiologisch molecuul absorbeert het lichaam?
- Geen levend fossiel:hoe de Coelacanth onlangs tientallen nieuwe genen heeft ontwikkeld
- Een 3D-cel maken
- Wetenschappers ontcijferen hoe planten zonnebrand voorkomen
- Batterijen verborgen laag onthuld
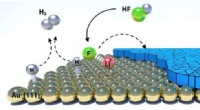
- Voor altijd vechten tegen chemicaliën met microben

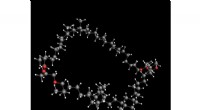
- Synthese van een van de meest voorkomende organische lipiden verheldert de structuur ervan
- Nieuw systeem maakt snel, antibioticabehandelingen op maat mogelijk

- COVID-19:een wake-up call om de toeleveringsketen van geneesmiddelen opnieuw in evenwicht te brengen?

 Wat is de meest waarschijnlijke oorzaak voor de groeihoek van een boom?
Wat is de meest waarschijnlijke oorzaak voor de groeihoek van een boom?  Trillende nanodruppeltjes kunnen een tumor binnendringen
Trillende nanodruppeltjes kunnen een tumor binnendringen Wat zijn kenmerken van radio -isotopen?
Wat zijn kenmerken van radio -isotopen?  Waar is de schaal voor op een thermometer?
Waar is de schaal voor op een thermometer?  Bij welk type symbiose leven bacteriën in de darmen van een koe om cellulose te helpen afbreken?
Bij welk type symbiose leven bacteriën in de darmen van een koe om cellulose te helpen afbreken?  Observatie van gekwantiseerde verwarming in kwantummaterie
Observatie van gekwantiseerde verwarming in kwantummaterie Hoe kunnen mensen een beschadigd ecosysteem herstellen?
Hoe kunnen mensen een beschadigd ecosysteem herstellen?  Groene aanpak versnelt procesoptimalisatie en terugwinning van schakelbare oplosmiddelen
Groene aanpak versnelt procesoptimalisatie en terugwinning van schakelbare oplosmiddelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

