
Wetenschap
Hoe worden elektronen gemeten in een georganiseerde atoom?
1. Energieniveaus (elektronenschalen):
* Elektronen bestaan in verschillende energieniveaus, vaak gevisualiseerd als concentrische schelpen rond de kern. Deze schelpen zijn genummerd 1, 2, 3, enzovoort, met hogere getallen die een hogere energieniveaus aangeven.
* Elektronen in een lagere schaal zijn dichter bij de kern en hebben een lagere energie dan die in hogere schalen.
* Het maximale aantal elektronen dat een schaal kan bezetten, wordt bepaald door de formule 2n², waarbij 'n' het schaalnummer is. De eerste shell (n =1) kan bijvoorbeeld maximaal 2 elektronen bevatten, de tweede schaal (n =2) kan 8 bevatten, enzovoort.
2. Subshells (orbitalen):
* Binnen elk energieniveau zijn er verdere divisies genaamd subshells. Deze worden aangeduid met letters:S, P, D en F.
* Elke subshell heeft een specifieke vorm en aantal orbitalen:
* s subshell: 1 sferisch orbitaal (bevat 2 elektronen)
* P Subshell: 3 haltervormige orbitalen (bevat 6 elektronen)
* d subshell: 5 complexe orbitalen (bevat 10 elektronen)
* f Subshell: 7 nog complexere orbitalen (bevat 14 elektronen)
* Het aantal subshells binnen een energieniveau komt overeen met het shell -nummer:
* Shell 1 heeft alleen de S -subshell
* Shell 2 heeft de S- en P -subshells
* Shell 3 heeft de S-, P- en D -subshells
* Shell 4 en hoger hebben S-, P-, D- en F -subshells
3. Orbitalen:
* Een orbitaal is een ruimte met ruimte rond de kern waar een grote kans is om een elektron te vinden.
* Elk orbitaal kan maximaal twee elektronen bevatten, die tegengestelde spins moeten hebben (spinnen en spinnen).
4. Vulorder (AUFBAU Principe en de regel van Hund):
* Elektronen vullen orbitalen in een specifieke volgorde, volgens het AUFBAU -principe:
* Elektronen komen eerst in de laagste energieniveaus.
* Binnen een subshell vullen elektronen orbitalen afzonderlijk voordat ze in hetzelfde orbitaal worden gekoppeld (de regel van Hund).
Voorbeeld:
* stikstof (n) heeft 7 elektronen:
* De eerste twee elektronen gaan naar de 1s orbital.
* De volgende twee gaan naar de 2s orbital.
* De resterende drie elektronen gaan naar de 2P -orbitalen, één elektron in elk orbitaal voordat een paar omhoog is.
Key Concepts:
* Quantumnummers: Deze getallen beschrijven de status van een elektron en omvatten het belangrijkste kwantumnummer (N), het azimutale kwantumnummer (L), het magnetische kwantumnummer (ml) en het spin -kwantumnummer (MS).
* Elektronenconfiguratie: Deze notatie vat de opstelling van elektronen in een atoom samen, wat de bezette schelpen, subschalen en orbitalen aangeeft.
Inzicht in de organisatie van elektronen binnen een atoom is cruciaal voor het verklaren van het chemische gedrag van elementen, binding en de vorming van moleculen.
 Klimaatbescherming:verregaande decarbonisatie tegen 2050 momenteel niet aannemelijk
Klimaatbescherming:verregaande decarbonisatie tegen 2050 momenteel niet aannemelijk Burgers en wetenschappers publiceren 28-jarig record van waterkwaliteit in Buzzards Bay
Burgers en wetenschappers publiceren 28-jarig record van waterkwaliteit in Buzzards Bay Waarom worden Darwins -ideeën vandaag algemeen geaccepteerd?
Waarom worden Darwins -ideeën vandaag algemeen geaccepteerd?  Belangrijke basisinformatie over ijsberen voor kinderen
Belangrijke basisinformatie over ijsberen voor kinderen  NASA's Terra-satelliet vangt een glimp op van een vluchtige Ema
NASA's Terra-satelliet vangt een glimp op van een vluchtige Ema
Hoofdlijnen
- Grootte doet er niet toe - althans voor hamerhaaien en zwemprestaties
- Genetische ontdekking nog een hulpmiddel in de strijd tegen tarweplagen
- Wat is het effect van verschillende soortenplanten die zeer DNA hebben?
- Wat we leren van een vis die in slechts 10 dagen van geslacht kan veranderen
- Waar komt ureum voornamelijk geconcentreerd?
- Wat is een algemeen kenmerk van nucleïnezuren?
- Uit mondiaal onderzoek blijkt dat er in het donker echt meer insecten buiten zijn
- Amerikaanse Republikeinen stemmen voor het afschaffen van de bescherming tegen wolven
- Wat is de rol van water?
- Een stabiele koperkatalysator voor de omzetting van kooldioxide

- Neutronen onthullen de wilde Weyl-wereld van halfmetalen

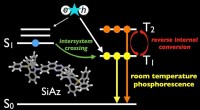
- Spannende tijden voor efficiënte, zware atoomvrije OLED's
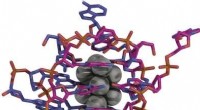
- Bepaling van de kristalstructuur van een DNA-gestabiliseerd zilveren nanocluster
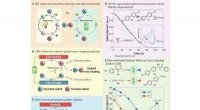
- Methode om microfluïdische elektrochemische technologieën toe te passen op redox-neutrale reacties met één elektronoverdracht
 Semi-willekeurige verstrooiing van licht
Semi-willekeurige verstrooiing van licht Wat zijn de namen van sterren in Hercules?
Wat zijn de namen van sterren in Hercules?  Hoe de Wronskian berekenen
Hoe de Wronskian berekenen  De breedte van een rechthoekig prisma vinden
De breedte van een rechthoekig prisma vinden Welke planeet het ongeveer 149,6 miljoen uit de zon?
Welke planeet het ongeveer 149,6 miljoen uit de zon?  Wanneer natriumnitraat ontleedt, worden nitriet en zuurstof gevormd, wat is de formule?
Wanneer natriumnitraat ontleedt, worden nitriet en zuurstof gevormd, wat is de formule?  Wat is de organische staatstheorie?
Wat is de organische staatstheorie?  Hoe T-teststatistieken berekenen
Hoe T-teststatistieken berekenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

