
Wetenschap
Wat is de opstelling van ionen in kristallen?
1. Elektrostatische interacties:
* Tegengestelde ladingen trekken aan: Positief geladen kationen en negatief geladen anionen trekken elkaar sterk aan en vormen de basis van de kristalstructuur.
* Like ladingen afstoten: Afstoting tussen ionen van dezelfde lading voorkomt dat ze aangrenzende posities innemen.
2. Verpakkingsefficiëntie:
* dichtstbijzijnde verpakking: Ionen hebben de neiging zich te rangschikken op een manier die de verpakkingsdichtheid maximaliseert, waardoor lege ruimte wordt geminimaliseerd.
* Coördinatienummer: Dit verwijst naar het aantal dichtstbijzijnde buurionen van tegengestelde lading rond een bepaald ion. Het coördinatienummer wordt beïnvloed door de relatieve afmetingen van de ionen.
3. Crystal Lattice:
* eenheidscel: De kleinste herhalende eenheid van de kristalstructuur wordt de eenheidscel genoemd. Het hele kristal kan worden opgebouwd door deze eenheidscel in drie dimensies te herhalen.
* Bravais -roosters: Er zijn 14 verschillende Bravais-roosters die alle mogelijke driedimensionale regelingen van punten beschrijven.
* Space Groups: De volledige symmetrie van een kristal wordt beschreven door zijn ruimtegroep, die het Bravais -rooster en de rangschikking van atomen in de eenheidscel omvat.
Gemeenschappelijke kristalstructuren:
* Eenvoudig kubiek: Elk ion wordt omgeven door zes naaste buren van tegenovergestelde lading.
* Face-gecentreerde kubieke (FCC): Elk ion wordt omgeven door twaalf naaste buren. Dit is een veel voorkomende structuur voor metalen.
* Body-gecentreerde kubieke (BCC): Elk ion wordt omgeven door acht dichtstbijzijnde buren.
* zeshoekige close-packed (HCP): Elk ion wordt omgeven door twaalf dichtstbijzijnde buren in een zeshoekige opstelling.
factoren die de kristalstructuur beïnvloeden:
* ionische straal: De grootte van de ionen speelt een belangrijke rol bij het bepalen van het coördinatienummer en de algehele structuur.
* ionische lading: De lading van de ionen beïnvloedt de sterkte van de elektrostatische interacties en dus de stabiliteit van de kristalstructuur.
* Temperatuur en druk: Deze factoren kunnen de relatieve stabiliteit van verschillende kristalstructuren beïnvloeden.
Voorbeelden:
* NaCl (tafelzout): Heeft een gezichtsgerichte kubieke structuur waarbij elk Na+ -ion wordt omgeven door zes climes en vice versa.
* cscl: Heeft een eenvoudige kubieke structuur waarbij elk CS+ -ion is omgeven door acht climes en vice versa.
* diamant: Hoewel het geen ionisch kristal is, demonstreert het het principe van het dichtstbijzijnde verpakking, waarbij elk koolstofatoom tetraëdrisch gecoördineerd is op vier andere koolstofatomen.
Inzicht in de rangschikking van ionen in kristallen is cruciaal op verschillende gebieden zoals materiaalwetenschap, mineralogie en kristallografie. Het helpt eigenschappen te voorspellen zoals smeltpunt, geleidbaarheid en hardheid van materialen.
 Onderzoekers passen E. coli aan om planten om te zetten in hernieuwbare chemicaliën
Onderzoekers passen E. coli aan om planten om te zetten in hernieuwbare chemicaliën Is de pH van 13 een zwak zuur of een sterke base?
Is de pH van 13 een zwak zuur of een sterke base?  Welk molecuul is propyn?
Welk molecuul is propyn?  Ontwikkeling van kern-schaal functionele composieten met uitstekende zelfsmerende eigenschappen
Ontwikkeling van kern-schaal functionele composieten met uitstekende zelfsmerende eigenschappen Chemici ontwikkelen motion capture-achtige technologie voor het volgen van eiwitvorm
Chemici ontwikkelen motion capture-achtige technologie voor het volgen van eiwitvorm
 NASA vangt vorming van tropische cycloon Dineo
NASA vangt vorming van tropische cycloon Dineo Een nieuw project om klimaatinnovatie in de gebouwde wereld te volgen en te waarderen
Een nieuw project om klimaatinnovatie in de gebouwde wereld te volgen en te waarderen De afname van fytoplankton valt samen met de opwarming van de aarde in de afgelopen 150 jaar
De afname van fytoplankton valt samen met de opwarming van de aarde in de afgelopen 150 jaar Wat zijn de natuurlijke hulpbronnen -industrie in Spanje?
Wat zijn de natuurlijke hulpbronnen -industrie in Spanje?  Welke planten leven in gematigde oceanen?
Welke planten leven in gematigde oceanen?
Hoofdlijnen
- Hoe heet het als een stengel opgroeit?
- Welke soorten planten zijn niet -leven?
- Waarom is het proces van hemiosmose belangrijk voor mensen?
- Wat is testbare hypothiesis?
- Oesterschelpen worden voor topprijzen verkocht terwijl biologen zich inspannen om schelpdierbanken te beschermen
- Hoe de combinatie van kennis van de Inuit en westerse wetenschap kan helpen de gezondheid van ijsberen te verbeteren
- Waarom moet de meeste wetenschap in de laboratoria worden uitgevoerd?
- Namen van vetten die meestal in planten aanwezig zijn?
- Wat zijn schildklierblaasjes?
- Biologisch afbreekbare kunststoffen uit palmolieafval

- Kooldioxide uit schoorstenen schrobben voor schonere industriële emissies

- Nieuwe ontdekkingen en inzichten in de glasovergang
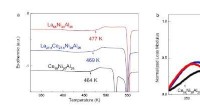
- Ingenieurs ontdekken nieuwe rol van water bij productie van hernieuwbare brandstoffen
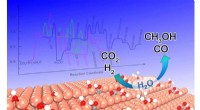
- Water zou de activiteit en selectiviteit van koolstofdioxidereductie kunnen moduleren
 Wat zijn de innerlijke planeten?
Wat zijn de innerlijke planeten?  Directe 2D-naar-3D-transformatie van pentekeningen
Directe 2D-naar-3D-transformatie van pentekeningen Wat zijn rockgroepen die geclassificeerd als clastic sedimentaire rotsen?
Wat zijn rockgroepen die geclassificeerd als clastic sedimentaire rotsen?  Aan het einde van de supermarkt kunnen zwermrobots je bestelling opnemen
Aan het einde van de supermarkt kunnen zwermrobots je bestelling opnemen Wat is de ademhaling van Paramecium?
Wat is de ademhaling van Paramecium?  Hoe gebruik je een refractor -telescoop om hemelse objecten te observeren?
Hoe gebruik je een refractor -telescoop om hemelse objecten te observeren?  Welke stralen hebben meer energie -bèta of gammastralen?
Welke stralen hebben meer energie -bèta of gammastralen?  Hoeveel pond in 96 gallons?
Hoeveel pond in 96 gallons?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

