
Wetenschap
Wat is de relatie tussen gastemperatuur en volume?
Bij constante druk is het volume van een gegeven massa van een ideaal gas recht evenredig met zijn absolute temperatuur.
Dit betekent dat als u de temperatuur van een gas verhoogt terwijl de druk constant blijft, het volume ook evenredig zal toenemen.
Hier is een eenvoudige uitleg:
* temperatuur is een maat voor de gemiddelde kinetische energie van de gasmoleculen.
* volume wordt de ruimte bezet door de gasmoleculen.
* Naarmate de temperatuur stijgt, bewegen de moleculen sneller en botsen vaker met de containerwanden.
* Deze verhoogde botsingsdruk duwt de containerwanden naar buiten, wat resulteert in een toename van het volume.
Wiskundig kan de wet van Charles worden uitgedrukt als:
V₁/t₁ =v₂/t₂
Waar:
* V₁ =eerste volume
* T₁ =initiële absolute temperatuur (in kelvin)
* V₂ =definitief volume
* T₂ =laatste absolute temperatuur (in kelvin)
Belangrijke opmerking:
* De wet van Charles is van toepassing op ideale gassen, die theoretische gassen zijn die zich perfect gedragen volgens de gaswetten.
* Echte gassen wijken af van ideaal gedrag bij hoge drukken en lage temperaturen.
* Om de wet van Charles te gebruiken, moet u de temperatuur uiten in Kelvin, niet Celsius.
Voorbeeld:
Als een ballon met een volume van 1 liter bij 20 ° C (293 K) wordt verwarmd tot 40 ° C (313 K), zal het volume toenemen tot:
V₂ =v₁ * t₂ / t₁
V₂ =1 l * 313 k / 293 k
V₂ ≈ 1.07 l
Het volume neemt met ongeveer 7% toe naarmate de temperatuur toeneemt met 20 ° C.
 Vloeistof-vloeistof fasescheiding blijkt het proces van het omzetten van spidroïne-eiwitten in spinnenwebvezels te stimuleren
Vloeistof-vloeistof fasescheiding blijkt het proces van het omzetten van spidroïne-eiwitten in spinnenwebvezels te stimuleren Wat is de organische staatstheorie?
Wat is de organische staatstheorie?  Wat zijn kenmerken van ionen?
Wat zijn kenmerken van ionen?  Studie maakt de weg vrij voor het maken van aan- en uitknoppen voor chemische reacties
Studie maakt de weg vrij voor het maken van aan- en uitknoppen voor chemische reacties Een chemische verandering produceert een ander soort materie?
Een chemische verandering produceert een ander soort materie?
 Wetenschappers laten zien hoe branden langs waterwegen in de tropische savanne van Australië bedreigde vogels bedreigen
Wetenschappers laten zien hoe branden langs waterwegen in de tropische savanne van Australië bedreigde vogels bedreigen  Een strandwalvis redden
Een strandwalvis redden Wat betekent Los Recursos Naturales?
Wat betekent Los Recursos Naturales?  4 manieren om meer over wetenschap te leren deze zomer
4 manieren om meer over wetenschap te leren deze zomer Onaanvaardbare kosten:savanneverbranding onder het Australische koolstofkredietschema schaadt de menselijke gezondheid
Onaanvaardbare kosten:savanneverbranding onder het Australische koolstofkredietschema schaadt de menselijke gezondheid
Hoofdlijnen
- Waarom moet je je lus niet vlammen en er dan snel bacteriën mee proberen op te pikken?
- Wat zijn enkele nadelen van de hermafrodietstaat bij dieren?
- Wat is het verschil tussen cellulaire ademhaling en fermantatie?
- Daling van huismus in verband met luchtvervuiling en slechte voeding
- Wat is het directe resultaat van aerobe ademhaling?
- Walvissen en dolfijnen hebben rijke mensachtige culturen en samenlevingen
- Wat is een pollenbuis?
- Hoe de verschillende soorten alveolaire cellen te identificeren
- Energiestroom (ecosysteem): definitie, proces en voorbeelden (met diagram)
- Slimmere medicijnafgifte dankzij controle over inkapseling
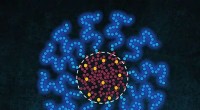
- Sensorpatch van textiel gemaakt met geleidende garens kan drukpunten voor geamputeerden detecteren

- Nieuwe katalysator kan betere lithium-zwavelbatterijen mogelijk maken, voeding van de volgende generatie elektronica

- Onderzoekers verkrijgen een belangrijke chemische verbinding

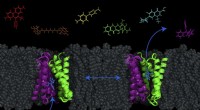
- Nieuw model onthult mogelijkheid om antibiotica in bacteriën te pompen
 Kan er op meer van het aardoppervlak leven plaatsvinden? De baanvorm van Jupiter speelt een belangrijke, over het hoofd geziene rol op aarde
Kan er op meer van het aardoppervlak leven plaatsvinden? De baanvorm van Jupiter speelt een belangrijke, over het hoofd geziene rol op aarde Hoe is het weer in het Afrikaanse regenwoud?
Hoe is het weer in het Afrikaanse regenwoud?  Zijn alle sterren op hetzelfde horizontale vlak?
Zijn alle sterren op hetzelfde horizontale vlak?  Bent u van plan om tijdens een sollicitatiegesprek om een hoog salaris te vragen? Denk nog eens na
Bent u van plan om tijdens een sollicitatiegesprek om een hoog salaris te vragen? Denk nog eens na  Programma dat Lake Champlain bestudeert, komt in aanmerking voor maximaal $ 1 miljoen
Programma dat Lake Champlain bestudeert, komt in aanmerking voor maximaal $ 1 miljoen Wat is de kracht die materie in wolken van ruimtestof aan elkaar trekt om sterren te creëren?
Wat is de kracht die materie in wolken van ruimtestof aan elkaar trekt om sterren te creëren?  Onderzoekers laden nanodragers om chemotherapiemedicijnen en beeldvormende moleculen aan tumoren te leveren
Onderzoekers laden nanodragers om chemotherapiemedicijnen en beeldvormende moleculen aan tumoren te leveren Wie is de oprichter van Planet Mars?
Wie is de oprichter van Planet Mars?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

