
Wetenschap
Waarom zijn edelen gassen speciaal?
1. Volledige buitenste schaal:
- Nobele gassen hebben een volledig gevulde buitenste elektronenschil, waardoor ze ongelooflijk stabiel en niet -reactief zijn. Deze volledige shell -configuratie voldoet aan de octetregel, waardoor ze extreem bestand zijn tegen het vormen van chemische bindingen.
2. Hoge ionisatie -energieën:
- Vanwege hun stabiele elektronenconfiguratie vereist het verwijderen van een elektron uit een edelgasatoom een aanzienlijke hoeveelheid energie, wat resulteert in hoge ionisatie -energieën.
3. Lage elektronenaffiniteiten:
- Nobele gassen hebben weinig neiging om een elektron te krijgen, omdat hun volledige buitenste schaal ze energetisch ongunstig maakt om extra elektronen te accepteren.
4. Kleurloos, geurloos en smakeloos:
- Onder standaardomstandigheden zijn edelgassen kleurloos, geurloos en smakeloos vanwege hun gebrek aan reactiviteit en zwakke interatomische krachten.
5. Slechte geleiders van warmte en elektriciteit:
- De zwakke interatomische krachten in edelgassen maken ze slechte geleiders van warmte en elektriciteit.
6. Monatomische gassen:
- Nobele gassen bestaan als monatomische gassen, wat betekent dat ze bestaan als afzonderlijke atomen in plaats van moleculen.
7. Lage kookpunten:
- Nobele gassen hebben zeer lage kookpunten vanwege de zwakke Van der Waals -krachten tussen hun atomen.
Toepassingen:
- Ondanks hun inertie hebben edelgassen een breed scala aan toepassingen vanwege hun unieke eigenschappen:
- helium: Gebruikt in ballonnen, luchtschepen en cryogenica.
- neon: Gebruikt in verlichting, bewegwijzering en lasers.
- argon: Gebruikt in lassen, gloeilampen en als een inerte atmosfeer.
- Krypton: Gebruikt in lasers, lampen met een hoge intensiteit en voor het daten van geologische monsters.
- Xenon: Gebruikt in lampen met hoge intensiteit, lasers en medische beeldvorming.
Samenvattend zijn edelgassen speciaal vanwege hun stabiele elektronische configuratie, wat leidt tot hun niet -reactieve aard, hoge ionisatie -energieën, lage elektronenaffiniteiten en andere onderscheidende eigenschappen. Deze eigenschappen maken ze waardevol voor verschillende toepassingen in verschillende industrieën.
 UAV-vliegtuigen bieden nieuwe inzichten in de vorming van de kleinste deeltjes in het noordpoolgebied
UAV-vliegtuigen bieden nieuwe inzichten in de vorming van de kleinste deeltjes in het noordpoolgebied Hoe het Chicxulub-botslichaam moderne regenwouden heeft doen ontstaan
Hoe het Chicxulub-botslichaam moderne regenwouden heeft doen ontstaan  De rol van de Zuidelijke Oceanen bij het stimuleren van de wereldwijde koolstofcyclus is sterker dan verwacht
De rol van de Zuidelijke Oceanen bij het stimuleren van de wereldwijde koolstofcyclus is sterker dan verwacht Voordelen en risico's voor het leven in zee van benaderingen voor het verwijderen van kooldioxide
Voordelen en risico's voor het leven in zee van benaderingen voor het verwijderen van kooldioxide Opname van een gewasmodel in een klimaatmodel
Opname van een gewasmodel in een klimaatmodel
Hoofdlijnen
- Genen die niet tot expressie worden gebracht als er een dominant gen aanwezig is opgeroepen?
- Welke groep is nauw verwant aan archabacteriën?
- Kan de groei van volwassen hersencellen de manier waarop we denken over veroudering veranderen?
- Wat zijn de soorten cellulaire
- Welke medische term gespecialiseerde witte bloedcellen die antilichamen produceren die worden gecodeerd aan specifieke antigenen?
- Orkaan Ian Street Shark-video tart geloof
- Wat overwinterende eekhoorns astronauten kunnen leren
- Hoe wetenschappers de gezondheid van walvissen in de gaten houden door drones te gebruiken om hun slag op te vangen
- Genetische studie van onsterfelijke kwallen kan de levensduur helpen verklaren
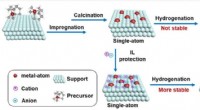
- Wetenschappers ontwikkelen strategie om afzonderlijke atomen te stabiliseren met ionische vloeistof als elektronische stabilisator
- Synthetische chemie haalt antikankerverbindingen uit de zeeslak en het laboratorium in

- Nieuwe hydrogel benut luchtvochtigheid voor praktische toepassingen
- Onderzoekers ontwikkelen materialen die een revolutie teweeg kunnen brengen in de manier waarop licht wordt gebruikt voor zonne-energie

- Uitzettend polymeer maakt zelfvouwende afdrukbare structuren mogelijk zonder verwarming of onderdompeling in water

 Onderzoek toont de robuuste opslag van qubits in ultrakoude polaire moleculen aan
Onderzoek toont de robuuste opslag van qubits in ultrakoude polaire moleculen aan Hoe wordt een spectrofotometer gekalibreerd?
Hoe wordt een spectrofotometer gekalibreerd?  Wat is het doel van een fasciotomie?
Wat is het doel van een fasciotomie?  Wat is het klimaat van BC?
Wat is het klimaat van BC?  Wat stijgt naar de oppervlakte en kan een vulkaan creëren?
Wat stijgt naar de oppervlakte en kan een vulkaan creëren?  Gevaar achter de schoonheid:er kunnen meer zonnestormen onze kant op komen
Gevaar achter de schoonheid:er kunnen meer zonnestormen onze kant op komen  Wat is het verschil tussen een habitat en gemeenschap?
Wat is het verschil tussen een habitat en gemeenschap?  Waarom reproduceren zoogdieren?
Waarom reproduceren zoogdieren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

