
Wetenschap
Wat het onderscheid tussen atomaire massa en nummer?
Atomisch nummer
* Definitie: Het atoomnummer vertegenwoordigt het aantal protonen in de kern van een atoom.
* Sleutelpunten:
* unieke identificatie: Elk element heeft een uniek atoomnummer. Het definieert het element.
* Locatie op het periodieke tabel: Elementen worden op het periodieke tabel gerangschikt door het atoomnummer te vergroten.
* Neutrale atomen: Het aantal protonen is gelijk aan het aantal elektronen in een neutraal atoom.
atomaire massa
* Definitie: De atomaire massa is de gemiddelde massa van een atoom van een element, rekening houdend met de verschillende isotopen van dat element.
* Sleutelpunten:
* gewogen gemiddelde: Het is niet de massa van een enkel atoom, maar een gemiddelde gebaseerd op de overvloed van elke isotoop.
* eenheden: Gemeten in atomaire massa -eenheden (AMU).
* isotopen: Isotopen zijn atomen van hetzelfde element met hetzelfde aantal protonen, maar een ander aantal neutronen, wat resulteert in verschillende atoommassa's.
Samenvattend
* atoomnummer (z): Definieert het element, gebaseerd op het aantal protonen.
* atomaire massa (a): Vertegenwoordigt de gemiddelde massa van een atoom van dat element, rekening houdend met al zijn isotopen.
Voorbeeld
Laten we koolstof (c) nemen:
* atoomnummer (z): 6 (wat betekent dat het 6 protonen heeft)
* atomaire massa (a): Ongeveer 12.011 AMU (vanwege de aanwezigheid van isotopen zoals koolstof-12 en koolstof-14)
Onthoud: Hoewel het atoomnummer een heel getal is, is de atomaire massa meestal een decimaal omdat het een gewogen gemiddelde van de isotopen is.
 Waarom hebben kleine veranderingen in de temperatuur op aarde een grote impact?
Waarom hebben kleine veranderingen in de temperatuur op aarde een grote impact?  Wetenschapper die het blad ontdekte?
Wetenschapper die het blad ontdekte?  Nieuw voorspellingssysteem waarschuwt inwoners van New Delhi over ongezonde lucht
Nieuw voorspellingssysteem waarschuwt inwoners van New Delhi over ongezonde lucht Waarom je beter nooit de weg hoeft te vragen als je Northern Territory in Australië bezoekt
Waarom je beter nooit de weg hoeft te vragen als je Northern Territory in Australië bezoekt  NASA legt moessonregens vast die overstromingen naar India brengen
NASA legt moessonregens vast die overstromingen naar India brengen
Hoofdlijnen
- Wat zijn de vier klassen van macromoleculen en hun belang?
- Zijn weg naar de top vinden:hoe een celoppervlakreceptor zijn bestemming bereikt
- Is het veilig om gekweekte zalm te voeren met borstelwormen die zijn gekweekt met visuitwerpselen?
- Onthulling van de genetische blauwdruk van saffloer
- Wat zijn bloedstollingseiwitten?
- Is een Seahorse uni-cellulair of multi-cellulair?
- Multiresistentie tegen antibiotica:waarom bacteriën zo effectief zijn
- Opinie:Generatieve AI dwingt mensen om opnieuw na te denken over wat het betekent om authentiek te zijn
- Hoeveel aminozuren zitten er in DNA en eiwitten?
- Een SN1-reactie gebruiken om quaternaire stereocentra te maken
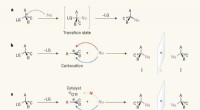
- Wetenschappers ontwikkelen betere manier om virussen te blokkeren die luchtweginfecties bij kinderen veroorzaken
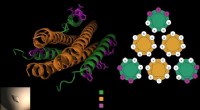
- Onderzoekers combineren levende en levenloze stoffen

- Magnetische T-Budbots gemaakt van theeplanten doden en reinigen biofilms

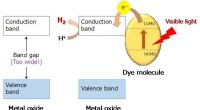
- Nieuw nanomateriaal ontwikkeld om watermoleculen te splitsen, verkrijgen van diwaterstof onder zonlicht
 UITLEG:Wat is een derecho?
UITLEG:Wat is een derecho? Wat zijn 4 hoofddelen van de wetenschappelijke methode?
Wat zijn 4 hoofddelen van de wetenschappelijke methode?  Wat is een grote vulkaan met hellende zijkanten?
Wat is een grote vulkaan met hellende zijkanten?  Maanfase waarin geen van het verlichte oppervlak van de aarde kan worden gezien, hoe wordt hoe?
Maanfase waarin geen van het verlichte oppervlak van de aarde kan worden gezien, hoe wordt hoe?  Wat zijn de moderne ruimtefaciliteiten en apparatuur om het universum te bestuderen?
Wat zijn de moderne ruimtefaciliteiten en apparatuur om het universum te bestuderen?  Wapens die niet door Britse officieren worden gebruikt bij de meeste politie-incidenten met geweld, gegevens suggereren:
Wapens die niet door Britse officieren worden gebruikt bij de meeste politie-incidenten met geweld, gegevens suggereren: De erfenis van oude ijstijden bepaalt hoe zeegrassen vandaag de dag reageren op bedreigingen voor het milieu
De erfenis van oude ijstijden bepaalt hoe zeegrassen vandaag de dag reageren op bedreigingen voor het milieu  De energietransformatie van een match
De energietransformatie van een match
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

