
Wetenschap
Wanneer zinkstaaf wordt gedompeld in sulfaatol, dan zal de concentratie van oplossingen na tijd zijn?
De reactie:
Zink (Zn) is reactiever dan veel metalen, waaronder het metaal dat het positieve ion vormt in een sulfaatoplossing (die koper, ijzer, enz. Kan zijn). Wanneer zink in een sulfaatoplossing wordt gedompeld, ondergaat het een verplaatsingsreactie .
Het zink zal reageren met de sulfaationen in de oplossing, het metaalion van de oplossing verplaatsen en zinksulfaat vormen. Dit wordt weergegeven door de volgende algemene reactie:
Zn (s) + M
2 +
(aq) + so 4
concentratie verandert:
* afname van metaalionconcentratie: De metaalionen die oorspronkelijk in de oplossing aanwezig zijn (m
2+
) worden vervangen door zinkionen (Zn
2+
). Daarom zal de concentratie van het metaalion afnemen.
* toename van de concentratie van zinkionen: Terwijl zink reageert, vormt het zinkionen (Zn
2+
), het verhogen van de concentratie van zinkionen in de oplossing.
* Sulfaationconcentratie blijft relatief constant: De sulfaationen (dus 4
Algemeen effect:
De concentratie van de sulfaatoplossing zal in de loop van de tijd veranderen. Specifiek:
* De concentratie van het oorspronkelijke metaalion zal dalen .
* De concentratie zinkionen zal verhogen .
* De concentratie sulfaationen blijft relatief constant .
factoren die de snelheid beïnvloeden:
* Aard van het metaal: De reactiviteit van zink in vergelijking met het oorspronkelijke metaalion zal de snelheid van de reactie bepalen. Meer reactief zink zal leiden tot een snellere reactie.
* concentratie van de oplossing: Een hogere concentratie van het oorspronkelijke metaalion zal in eerste instantie leiden tot een snellere reactiesnelheid.
* Temperatuur: Hogere temperaturen verhogen in het algemeen de reactiesnelheid.
Belangrijke opmerking: Als de sulfaatoplossing sterk geconcentreerd is, ziet u mogelijk de vorming van zinksulfaatprecipitaat, die zinkionen uit de oplossing zou verwijderen en de totale concentratieveranderingen zou beïnvloeden.
 Verschillen tussen Fullers Earth & Diatomaceous Earth
Verschillen tussen Fullers Earth & Diatomaceous Earth  Waarom is er weinig vegetatie op de vloer van tropisch regenwoud?
Waarom is er weinig vegetatie op de vloer van tropisch regenwoud?  Een voorbeeld van iets dat voortkomt uit de natuur die mensen gebruiken?
Een voorbeeld van iets dat voortkomt uit de natuur die mensen gebruiken?  Noem de basisbehoeften waarin de habitat voorziet om te overleven en zich voort te planten?
Noem de basisbehoeften waarin de habitat voorziet om te overleven en zich voort te planten?  Te koop:uniek stuk grond in strategische Arctische archipel
Te koop:uniek stuk grond in strategische Arctische archipel
Hoofdlijnen
- Waar komt in het menselijk lichaam osmose op?
- Wanneer is de neutrale theorie van moleculaire evolutie gecreëerd?
- Nieuwe genetische variatie van oude en exotische variëteiten voor milieuvriendelijke tarweteelt
- Het oversteken van organismen van de F1 -generatie produceert welke generatie?
- Wat doet mitochondriën in een zenuwcel?
- Nieuwe bevindingen werpen licht op hoe bella-motten gif gebruiken om partners aan te trekken
- Denken dieren rationeel? Onderzoeker suggereert dat rationele besluitvorming geen taal vereist
- Wat wordt het proces genoemd door welke organismen verantwoordelijk zijn voor het produceren van stikstofverbindingen?
- Waarom beschouwt water een afval in cellulaire ademhaling?
- Metaalinnovatie biedt een unieke, kosteneffectieve optie voor sanitair en productie-industrieën

- David vs Goliath:hoe een klein molecuul astma-aanvallen kan verslaan
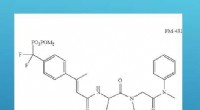
- Koolstofafvangtechnologie verwijdert CO2 van energiecentrales zoals duikuitrusting

- Techniek om tweecomponenten biologische sensoren te finetunen
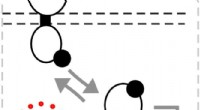
- De smaak behouden, het verminderen van het zout

 Chiraliteit-gecontroleerde groei van enkelwandige koolstofnanobuisjes
Chiraliteit-gecontroleerde groei van enkelwandige koolstofnanobuisjes Hoe u een luchtvaartpiloot kunt worden
Hoe u een luchtvaartpiloot kunt worden  Hoe levende materialen uit algen het beste koolstof kunnen vastleggen
Hoe levende materialen uit algen het beste koolstof kunnen vastleggen  Prehistorische massagraven kunnen in verband worden gebracht met tsunami's, nieuw onderzoek onthult
Prehistorische massagraven kunnen in verband worden gebracht met tsunami's, nieuw onderzoek onthult Rusland meldt computerfout op International Space Station
Rusland meldt computerfout op International Space Station Waarom wordt de mantaal van de aarde beschreven als een semi -vaste stof?
Waarom wordt de mantaal van de aarde beschreven als een semi -vaste stof?  Lava van vulkaan op Spaans eiland rolt langzaam richting zee
Lava van vulkaan op Spaans eiland rolt langzaam richting zee Wat produceert een allel?
Wat produceert een allel?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

