
Wetenschap
Hoe verschillen de edelgassen van andere families op het periodieke tabel?
1. Volledige valentie -shell:
- Nobele gassen bezitten een volledige buitenste schaal van elektronen, waardoor ze uitzonderlijk stabiel en niet -reactief zijn. Deze volledige shell -configuratie is de sleutel tot hun inerte aard.
2. Gebrek aan kleur en geur:
- De meeste edelgassen zijn kleurloos en geurloos onder standaardomstandigheden. Dit komt door hun inerte aard, omdat ze geen gemakkelijk bindingen vormen en deelnemen aan chemische reacties.
3. Monoatomisch bestaan:
- Nobele gassen bestaan als enkele atomen (monatomisch) in plaats van moleculen te vormen. Dit is een direct gevolg van hun stabiele elektronenconfiguratie, waardoor ze elektronen kunnen delen om bindingen te vormen.
4. Lage kookpunten:
- Vanwege hun zwakke interatomische krachten hebben edelgassen zeer lage kookpunten. Helium heeft bijvoorbeeld het laagste kookpunt van alle elementen.
5. Gevonden in sporenhoeveelheden in de atmosfeer:
- Nobele gassen worden in zeer kleine hoeveelheden in de atmosfeer gevonden. Hun inerte aard voorkomt dat ze met andere elementen reageren en verbindingen vormen, wat bijdraagt aan hun lage atmosferische overvloed.
6. Beperkte chemische reactiviteit:
- Hoewel eenmaal als volledig niet -reactief wordt beschouwd, is aangetoond dat sommige edelgassen verbindingen vormen onder specifieke omstandigheden, vooral met zeer elektronegatieve elementen zoals fluor. Hun algehele reactiviteit blijft echter extreem beperkt in vergelijking met andere elementengroepen.
7. Toepassingen:
- Ondanks hun beperkte reactiviteit hebben edelgassen talloze toepassingen op verschillende gebieden:
- helium: Gebruikt in ballonnen, cryogene en MRI -machines.
- neon: Gebruikt in neonborden en lasers.
- argon: Gebruikt in lassen, gloeilampen en als een inerte atmosfeer voor chemische processen.
- Krypton: Gebruikt in lasers en verlichting met een hoge intensiteit.
- Xenon: Gebruikt in flitslampen, lasers en als een verdoving.
Samenvattend zijn de edelgassen uniek vanwege hun volledige valentieschil, wat resulteert in hun inerte aard, gebrek aan kleur en geur, monoatomisch bestaan, lage kookpunten, beperkte chemische reactiviteit en diverse toepassingen.
 Chemici verkregen nieuwe verbinding voor moleculaire machines
Chemici verkregen nieuwe verbinding voor moleculaire machines Zijn de reactanten van lichte reacties?
Zijn de reactanten van lichte reacties?  Een rechtvaardiging voor de Zuid-Koreaanse wetenschapper?
Een rechtvaardiging voor de Zuid-Koreaanse wetenschapper?  Onderzoekers maken de volgende generatie, batterijcomponent met hoge taaiheid
Onderzoekers maken de volgende generatie, batterijcomponent met hoge taaiheid Van welk mengsel van gassen wordt gedacht dat het de aarde heeft verzonnen?
Van welk mengsel van gassen wordt gedacht dat het de aarde heeft verzonnen?
 Onderzoekers ontwikkelen stresstest om te voorspellen hoe diatomeeën zullen reageren op verzuring van de oceaan
Onderzoekers ontwikkelen stresstest om te voorspellen hoe diatomeeën zullen reageren op verzuring van de oceaan De toepassing van de wetenschappelijke benadering van sociale wereld staat bekend als?
De toepassing van de wetenschappelijke benadering van sociale wereld staat bekend als?  De manier waarop een plant groeit of buigt als reactie op de zwaartekracht wordt genoemd?
De manier waarop een plant groeit of buigt als reactie op de zwaartekracht wordt genoemd?  Atmosferische ijsdeeltjes kleiner en vallen sneller dan modellen hadden aangenomen
Atmosferische ijsdeeltjes kleiner en vallen sneller dan modellen hadden aangenomen Meegaan met de ijsschots:zee-ijsbewegingen volgen de dynamiek die het nieuwe Noordpoolgebied transformeert
Meegaan met de ijsschots:zee-ijsbewegingen volgen de dynamiek die het nieuwe Noordpoolgebied transformeert
Hoofdlijnen
- Uit onderzoek blijkt hoe een suikerdetecterend eiwit als ‘machine’ fungeert om plantengroei (en olieproductie) aan en uit te zetten
- Hoe wordt het genoemd als wetenschappers onderzoeken hoe goed wetenschappers de wetenschappelijke methode volgen?
- Zouden mensen bereid zijn hun persoonsgegevens af te staan voor onderzoek?
- Wetenschappers ontwikkelen nieuwe techniek om het verborgen genoom te onthullen
- Hoe verschillende mierensoorten in hetzelfde territorium naast elkaar bestaan
- Welk organisme voert geen fotosynthese uit?
- Wat zijn 3 klassen dieetlipiden?
- Onderzoek van 300 miljoen jaar oude ontlasting vindt vlees op het menu
- Ben jij een zoetekauw? Honingbijen klauwen
- Hoe gebogen oppervlakken in alle vormen uitzetten en samentrekken?

- Eerste microarrayed 3D-neuronaal cultuurplatform ontwikkeld
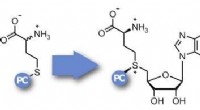
- Enzymatische photocaging voor de studie van genregulatie door middel van DNA-methylatie
- Nieuwe zelf-assemblerende eiwithydrogels kunnen vele toepassingen voor biogeneeskunde bevatten

- Onderzoeksbevinding kan het energieverbruik en de kosten bij het maken van silicium verlagen

 Welke planeet is vernoemd naar de Griekse God van de zee?
Welke planeet is vernoemd naar de Griekse God van de zee?  Welke formule relateert gewicht en massa?
Welke formule relateert gewicht en massa?  Wat is de naam van de meest krachtige van nature voorkomend magnetische rots?
Wat is de naam van de meest krachtige van nature voorkomend magnetische rots?  Archeologen vinden oude pottenbakkerij in Egypte
Archeologen vinden oude pottenbakkerij in Egypte Worden erkennis gevonden in een ander sterrenstelsel?
Worden erkennis gevonden in een ander sterrenstelsel?  Een revolutie teweegbrengen in de monitoring van de waterkwaliteit voor onze rivieren en rif
Een revolutie teweegbrengen in de monitoring van de waterkwaliteit voor onze rivieren en rif Computermodel voorspelt de waarschijnlijkheid dat verschillende gevaarlijke drempels voor klimaatverandering worden overschreden
Computermodel voorspelt de waarschijnlijkheid dat verschillende gevaarlijke drempels voor klimaatverandering worden overschreden Onderzoekers stellen het gebruik van kwantumcascadelasers voor om privécommunicatie in de vrije ruimte te bereiken
Onderzoekers stellen het gebruik van kwantumcascadelasers voor om privécommunicatie in de vrije ruimte te bereiken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

