
Wetenschap
Hoe kan water worden omgezet in zijn samenstellende elementen?
Hier is hoe het werkt:
1. Elektrolyse -instelling: Een directe elektrische stroom wordt door water geleid. Dit wordt gedaan door twee elektroden (meestal gemaakt van een inerte materiaal zoals platina) onder te dompelen in het water en ze te verbinden met een stroombron.
2. Ontleding: Wanneer de stroom stroomt, biedt het de energie die nodig is om de chemische bindingen te verbreken die de waterstof- en zuurstofatomen bij elkaar houden in watermoleculen.
3. Gasevolutie:
* waterstof (H₂) gas wordt geproduceerd bij de negatieve elektrode (kathode) als waterstofionen (H+) -greep elektronen.
* zuurstof (o₂) gas wordt geproduceerd bij de positieve elektrode (anode) omdat zuurstofionen (o²-) elektronen verliezen.
De chemische reactie:
De algehele elektrolysereactie kan worden weergegeven als:
2h₂o (l) → 2h₂ (g) + o₂ (g)
belangrijke opmerkingen:
* Puur water: Elektrolyse werkt het beste met enigszins zuur of basisch water, omdat zuiver water een slechte geleider van elektriciteit is.
* Veiligheid: Elektrolyse kan gevaarlijk zijn als het niet correct wordt uitgevoerd. Gebruik altijd geschikte veiligheidsmaatregelen, vooral bij het omgaan met elektriciteit en ontvlambare gassen.
Toepassingen van elektrolyse:
* waterstofproductie: Elektrolyse is een veelbelovende methode voor het produceren van waterstof als schone brandstof.
* zuurstofproductie: Elektrolyse kan worden gebruikt om zuurstof te genereren voor verschillende industriële toepassingen.
* waterzuiverheid: Elektrolyse kan worden gebruikt om water te zuiveren door opgeloste onzuiverheden te verwijderen.
Laat het me weten als je nog andere vragen hebt!
 Wat is het proces waarbij moleculen zich gelijkmatig door de kamer verspreiden?
Wat is het proces waarbij moleculen zich gelijkmatig door de kamer verspreiden?  Wat is de chemische formule voor dihydrogen fluoride?
Wat is de chemische formule voor dihydrogen fluoride?  Welk niveau is geïntegreerde chemie en natuurkunde?
Welk niveau is geïntegreerde chemie en natuurkunde?  Is zirkoniumoxide een ionische verbinding?
Is zirkoniumoxide een ionische verbinding?  Een oplossing die de maximale hoeveelheid opgeloste stof bevat, is een onverzadigde oplossing?
Een oplossing die de maximale hoeveelheid opgeloste stof bevat, is een onverzadigde oplossing?
 Is het Middellandse-Zeegebied echt een hotspot van milieuverandering?
Is het Middellandse-Zeegebied echt een hotspot van milieuverandering? Kan vervuiling het gedrag van dieren in het wild veranderen?
Kan vervuiling het gedrag van dieren in het wild veranderen? Miljarden dode bomen dwingen Amerikaanse brandweerlieden om van tactiek te veranderen
Miljarden dode bomen dwingen Amerikaanse brandweerlieden om van tactiek te veranderen Slowaakse Wastebusters op kruistocht tegen zwerfvuil
Slowaakse Wastebusters op kruistocht tegen zwerfvuil Kunnen we ‘citizen science’ beter maken?
Kunnen we ‘citizen science’ beter maken?
Hoofdlijnen
- Waarom het belangrijk is om parasieten te redden
- Welke suikers niet gevonden in planten?
- Hoe inktviscamouflage huidkanker bij mensen kan helpen voorkomen
- Wat is een reeks structuren die in de kern zijn gevonden, DNA plus wat eiwit?
- Onafhankelijk en afhankelijk zijn dit soorten in de wetenschap?
- Waarom stijgen gist in warme of koude temperaturen?
- Wat is de functie van mannose?
- Wat zijn cellen die geen afzonderlijke kern hebben genoemd?
- Kunnen menselijk gedrag en mentale processen worden bestudeerd met behulp van de wetenschappelijke methode?
- Traditionele eutectische legering biedt nieuwe hoop voor metaal-zuurstofbatterijen met hoge energiedichtheid

- Onderzoekers vinden een manier om vrijstaande films van perovskietoxiden te maken
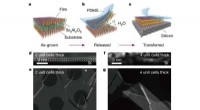
- Levende cellen geïntegreerd in fijne structuren gemaakt in een 3D-printer

- Elektronische entropie verbetert de watersplitsing

- Wetenschappers ontdekken mechanismen achter thermo-elektrisch materiaal
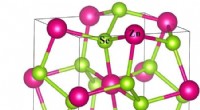
 Waar de reproductieve delen van een angiosperm?
Waar de reproductieve delen van een angiosperm?  Door mensen aangebrachte veranderingen op de rivier de Mississippi verhoogden extreme overstromingen
Door mensen aangebrachte veranderingen op de rivier de Mississippi verhoogden extreme overstromingen Waarom is de vernietiging van regenwouden een probleem?
Waarom is de vernietiging van regenwouden een probleem?  Wat is het proces waarin mineralen oplossen als water in rotsen weken die een natuurlijk cement vormen?
Wat is het proces waarin mineralen oplossen als water in rotsen weken die een natuurlijk cement vormen?  Stel dat een bug tegelijkertijd op en neer zwemt op en neer zwemt in vergelijking met frequentie die golven van golf bereiken is?
Stel dat een bug tegelijkertijd op en neer zwemt op en neer zwemt in vergelijking met frequentie die golven van golf bereiken is?  Voor het eerst experimenteel aangetoonde sterker-dan-binaire correlaties
Voor het eerst experimenteel aangetoonde sterker-dan-binaire correlaties Radar ontwikkeld voor snelle redding van begraven mensen
Radar ontwikkeld voor snelle redding van begraven mensen Grote levensgebeurtenissen die op sociale media worden gedeeld, doen sluimerende verbindingen herleven, studie toont
Grote levensgebeurtenissen die op sociale media worden gedeeld, doen sluimerende verbindingen herleven, studie toont
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

