
Wetenschap
Waarom is water een molecuul polair?
1. Elektronegativiteitsverschil:
* Zuurstof is elektronegatiefer dan waterstof, wat betekent dat het een sterkere trek heeft op de gedeelde elektronen in de O-H-bindingen.
* Dit creëert een gedeeltelijke negatieve lading (Δ-) op het zuurstofatoom en gedeeltelijke positieve ladingen (Δ+) op de waterstofatomen.
2. Gebogen moleculaire geometrie:
* De twee O-H-bindingen in water zijn gerangschikt in een gebogen vorm en vormen een hoek van ongeveer 104,5 graden.
* Deze vorm voorkomt dat de gedeeltelijke kosten elkaar opzeggen.
3. Ongelijke verdeling van de kosten:
* De gedeeltelijke negatieve lading op het zuurstofatoom en de gedeeltelijke positieve ladingen op de waterstofatomen creëren een ongelijke ladingsverdeling over het molecuul.
* Deze ongelijke verdeling resulteert in een dipoolmoment, waarbij het zuurstofuiteinde enigszins negatief is en het waterstofuiteinde enigszins positief is.
Samenvattend:
Water's polaire aard komt voort uit de combinatie van zijn:
* Elektronegativiteitsverschil tussen zuurstof en waterstof,
* gebogen moleculaire geometrie , En
* ongelijke verdeling van kosten resulterend in een dipoolmoment.
Met deze polariteit kan water waterstofbruggen vormen met andere watermoleculen en met andere polaire moleculen, wat bijdraagt aan zijn unieke eigenschappen, zoals een hoog kookpunt, hoge oppervlaktespanning en het vermogen om veel stoffen op te lossen.
 Afval om te koesteren:Rivierkreeftschelpen om energie op te slaan
Afval om te koesteren:Rivierkreeftschelpen om energie op te slaan Wat is de pH van een oplossing met H 7.010-2?
Wat is de pH van een oplossing met H 7.010-2?  Wat zijn de factoren die een chemische verandering bepalen?
Wat zijn de factoren die een chemische verandering bepalen?  Onderzoekers rapporteren omgekeerde magnesiumchemie-ontdekking
Onderzoekers rapporteren omgekeerde magnesiumchemie-ontdekking Welke kernreactie combineert gas om helium te vormen en produceert het grootste deel van de energie van de zon?
Welke kernreactie combineert gas om helium te vormen en produceert het grootste deel van de energie van de zon?
 Bossen kunnen het vermogen verliezen om te beschermen tegen extreme klimaatverandering, studie vondsten
Bossen kunnen het vermogen verliezen om te beschermen tegen extreme klimaatverandering, studie vondsten Tribale stem verwerpt plannen voor ondergrondse opslag van radioactief afval nabij Lake Huron
Tribale stem verwerpt plannen voor ondergrondse opslag van radioactief afval nabij Lake Huron Gladde redding:kan zeewier als koeienvoer het klimaat helpen?
Gladde redding:kan zeewier als koeienvoer het klimaat helpen?  Koolstofbeprijzing en financiële overdrachten:kleine veranderingen kunnen een enorm effect hebben op klimaatgelijkheid
Koolstofbeprijzing en financiële overdrachten:kleine veranderingen kunnen een enorm effect hebben op klimaatgelijkheid Hoe milieuactivisten zich kunnen hergroeperen voor het Trump-tijdperk
Hoe milieuactivisten zich kunnen hergroeperen voor het Trump-tijdperk
Hoofdlijnen
- Wetenschappers ontdekken hoe het SARS-CoV-2-virus het replicatieprogramma in geïnfecteerde cellen initieert
- Een benadering van het hele lichaam om chemosensorische cellen te begrijpen
- Wat is chloorflukoolstof?
- Hoe voeden schimmels?
- Wat is het weefsel dat bestaat uit celvezels en matrix?
- Wat voor soort bacteriën voedt zich met dode dingen?
- Waarom is een controle nodig in de wetenschappelijke methode?
- Invasieve soorten lieveheersbeestjes bedreigt andere lieveheersbeestjes in Engeland
- DNA is gewikkeld rond een speciaal eiwit?
- Verbeterde eiwitfunctie opent weg voor nieuw concept voor geneesmiddelontwikkeling
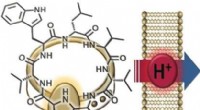
- Chemische synthese toont aan dat antibioticum uit de menselijke neus werkt door protontranslocatie
- Deuteratie van moleculen met behulp van enzymen

- Nieuwe microscopie werkt bij extreme hitte, werpt licht op legeringen voor kernreactoren

- Onderzoekers onderzoeken complexe moleculaire structuren

 Machine learning in actie voor de humanitaire sector
Machine learning in actie voor de humanitaire sector Evolutie wordt nu geaccepteerd door een meerderheid van de Amerikanen
Evolutie wordt nu geaccepteerd door een meerderheid van de Amerikanen Leef snel, sterf jong:signaaldetectietheorie bijwerken
Leef snel, sterf jong:signaaldetectietheorie bijwerken Wetenschappers vinden mogelijke ontbrekende schakel in chemie die leidde tot leven op aarde
Wetenschappers vinden mogelijke ontbrekende schakel in chemie die leidde tot leven op aarde Kan een propaantank exploderen?
Kan een propaantank exploderen?  Gouden nanodeeltjesclusters voor gelijktijdige fotothermische beeldvorming en therapie
Gouden nanodeeltjesclusters voor gelijktijdige fotothermische beeldvorming en therapie Schietpartij Duitsland live gestreamd ondanks inspanningen van techbedrijven (update)
Schietpartij Duitsland live gestreamd ondanks inspanningen van techbedrijven (update) Hoe je katoen kunt verven met eikels en roest
Hoe je katoen kunt verven met eikels en roest
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

