
Wetenschap
Hoe bereken je de pH voor een oplossing?
Inzicht in pH
* pH -schaal: De pH -schaal meet de zuurgraad of alkaliteit van een oplossing. Het varieert van 0 tot 14.
* pH 0-6: Zure (hogere concentratie van H+ ionen)
* pH 7: Neutrale (gelijke concentratie van H+ en OH-ionen)
* pH 8-14: Basis of alkalisch (hogere concentratie OH-ionen)
PH berekenen
1. De concentratie waterstofionen kennen ([H+])
* Directe berekening: De meest eenvoudige manier is om de volgende formule te gebruiken:
* pH =-log [H+]
* Waar [H+] de concentratie van waterstofionen in mol is per liter (M).
Voorbeeld: Als de [H+] van een oplossing 1 x 10^-4 m is, dan:
* pH =-log (1 x 10^-4) =4
2. Kennis van de hydroxide-ionenconcentratie ([oh-])
* met behulp van de ionenproductconstante (KW): KW is een constante waarde voor water bij een specifieke temperatuur (meestal 25 ° C). KW =[H+] [OH-] =1 x 10^-14
* Stap 1: Bereken [H+] met behulp van de vergelijking:[H+] =KW/[OH-]
* Stap 2: Bereken pH met behulp van de formule:ph =-log [h+]
Voorbeeld: Als de [OH-] van een oplossing 1 x 10^-10 m is, dan:
* [H+] =(1 x 10^-14) / (1 x 10^-10) =1 x 10^-4 m
* pH =-log (1 x 10^-4) =4
Belangrijke overwegingen:
* Sterke zuren en basen: Sterke zuren en basen ioniseren volledig in oplossing. Om de pH te berekenen, kunt u de initiële concentratie van het zuur of de basis direct gebruiken.
* Een 0,1 M oplossing van HCl (een sterk zuur) heeft bijvoorbeeld een [H+] van 0,1 m, waardoor de pH gelijk is aan 1.
* Zwakke zuren en basen: Zwakke zuren en basen ioniseren slechts gedeeltelijk. U moet een evenwichtsconstante (KA voor zuren, KB voor basen) gebruiken om de [H+] of [OH-] te berekenen voordat de pH wordt berekend.
* buffers: Buffers zijn oplossingen die weerstand bieden aan veranderingen in pH. Ze bevatten een zwak zuur en zijn conjugaatbasis of een zwakke basis en het conjugaatzuur. Speciale berekeningen zijn nodig voor buffers met de Henderson-Hasselbalch-vergelijking.
* Temperatuur: De waarde van KW verandert met temperatuur. Zorg ervoor dat u de juiste KW -waarde gebruikt voor de temperatuur waarbij uw oplossing wordt gemeten.
Een pH -meter gebruiken:
* De meest nauwkeurige manier om de pH te meten is met een pH -meter, die een direct lezen biedt.
Laat het me weten als u berekeningen wilt verkennen voor specifieke soorten oplossingen (zoals sterke zuren, zwakke basen of buffers). Ik ben blij om te helpen!
 Miljoenen ellende terwijl de moesson de havenstad van Pakistan binnenstormt
Miljoenen ellende terwijl de moesson de havenstad van Pakistan binnenstormt Zweden wordt de komende dagen geconfronteerd met extreem brandgevaar
Zweden wordt de komende dagen geconfronteerd met extreem brandgevaar 5 kenmerken die alle vissen gemeen hebben
5 kenmerken die alle vissen gemeen hebben  Wetgevers van het Minnesota House dringen aan op een belasting op meststoffen om verontreinigde bronnen schoon te maken
Wetgevers van het Minnesota House dringen aan op een belasting op meststoffen om verontreinigde bronnen schoon te maken  NASA volgt potentiële tropische cycloon 9 naar het oosten van de Caraïben
NASA volgt potentiële tropische cycloon 9 naar het oosten van de Caraïben
Hoofdlijnen
- Waarom cellen de doorgang van ziekten toestaan
- Wat bevat een celwandchloroplast en grote vacuole?
- Kunnen planten denken?
- Hoe zijn gymnospermen en angiospermen verschillend?
- Wat ontgift de cel?
- Hoe melkveehouders zich kunnen aanpassen aan klimaatverandering
- Door UC geleid team laat zien hoe de bacteriële gemeenschap evolueert
- Hebben bacteriën enzymen voor het uitvoeren van metabole activiteiten?
- Waar zijn de twee eerste groepen organismen in geplaatst?
- Samen beter:Samengevoegde microscoop biedt ongekende kijk op biologische processen
- Wetenschappers onthullen structuur van aminozuurtransporter die betrokken is bij kanker

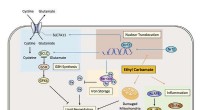
- Wetenschappers ontdekken het mechanisme voor ethylcarbamaat-geïnduceerde toxiciteit in gefermenteerd voedsel
- Ontdekking onthult noodzaak voor ammoniakemissieregelgeving

- Kunstmatige intelligentie gebruiken om de rozen te ruiken

 Wat Love Island ons kan vertellen over de geschiedenis van de liefde
Wat Love Island ons kan vertellen over de geschiedenis van de liefde Het dollarwinkeldieet:onderzoek toont aan dat kortingsproducten overeenkomen met de kwaliteit van traditionele ketens
Het dollarwinkeldieet:onderzoek toont aan dat kortingsproducten overeenkomen met de kwaliteit van traditionele ketens Vormveranderend plankton:hoe plankton omgaat met turbulentie
Vormveranderend plankton:hoe plankton omgaat met turbulentie Nieuwe berekeningsaanpak maakt nauwkeurigere voorspellingen mogelijk van hoe atomen ioniseren wanneer ze worden beïnvloed door hoogenergetische elektronen
Nieuwe berekeningsaanpak maakt nauwkeurigere voorspellingen mogelijk van hoe atomen ioniseren wanneer ze worden beïnvloed door hoogenergetische elektronen  Hoe blootstelling aan negatieve feedback doelgericht consumentengedrag beïnvloedt
Hoe blootstelling aan negatieve feedback doelgericht consumentengedrag beïnvloedt Water kan bijtend zijn voor het leven, dus hoe zit het met alternatieve oplosmiddelen?
Water kan bijtend zijn voor het leven, dus hoe zit het met alternatieve oplosmiddelen? Hoe HP naar BTU /hr
Hoe HP naar BTU /hr Zweetsensor detecteert stressniveaus; Kan worden gebruikt bij verkenning van de ruimte
Zweetsensor detecteert stressniveaus; Kan worden gebruikt bij verkenning van de ruimte
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

