
Wetenschap
Welk gas voldoet aan de wetten op alle omstandigheden van temperatuur en druk?
Dit is waarom:
* Ideale veronderstellingen van gaswetgeving: De ideale gaswet is gebaseerd op de volgende veronderstellingen:
* Gasmoleculen hebben een verwaarloosbaar volume.
* Gasmoleculen interageren niet met elkaar (geen aantrekkelijke of afstotende krachten).
* echt gasgedrag: Echte gassen wijken af van ideaal gedrag omdat:
* Moleculair volume: Bij hoge druk wordt het volume bezet door gasmoleculen aanzienlijk in vergelijking met het totale volume, waardoor het verwaarloosbare volume -veronderstelling ongeldig is.
* intermoleculaire krachten: Bij lage temperaturen worden intermoleculaire krachten prominenter, waardoor moleculen elkaar aantrekken en afwijken van ideaal gedrag.
Sommige gassen komen echter dichter bij ideaal gedrag onder bepaalde omstandigheden:
* Lage druk: Bij lage drukken is het volume bezet door gasmoleculen veel kleiner dan het totale volume en zijn intermoleculaire krachten zwakker.
* Hoge temperatuur: Bij hoge temperaturen overwint de kinetische energie van moleculen intermoleculaire krachten.
Daarom is de ideale gaswet een goede benadering voor echte gassen onder omstandigheden van lage druk en hoge temperatuur. Maar het is belangrijk om te onthouden dat geen gas zich in alle aan alle omstandigheden perfect gedraagt.
 Ontdek de betekenis en genezende eigenschappen van aventurijn in 2023
Ontdek de betekenis en genezende eigenschappen van aventurijn in 2023  Wikipedia 'edit wars' toont de dynamiek van het ontstaan en oplossen van conflicten
Wikipedia 'edit wars' toont de dynamiek van het ontstaan en oplossen van conflicten  Studie werpt nieuw licht op hoe jonge boomzaailingen zich ontwikkelen
Studie werpt nieuw licht op hoe jonge boomzaailingen zich ontwikkelen  De onzekere rol van aardgas in de transitie naar schone energie
De onzekere rol van aardgas in de transitie naar schone energie Poll:Rampen beïnvloeden denken over klimaatverandering
Poll:Rampen beïnvloeden denken over klimaatverandering
Hoofdlijnen
- Elektronenmicroscoopbeelden laten zien hoe cellen een vitaal mineraal opnemen
- Hoe plantencel en dieren anders?
- Hoe wordt het genoemd als een nieuw organisme voortkomt uit het ouderorganisme?
- Hoe noteer ik een Karyotype
- Tegelijkertijd inzoomen door tijd en ruimte met superresolutie om te begrijpen hoe cellen zich delen
- Ziet RNA eruit als ladder in tweeën gesneden?
- Waar vindt aerobe en anerobe ademhaling plaats?
- Welk type celdeling creëert X en Y?
- Wat betekent de term haploïde?
- Poreus kristal leidt reactie om koolstofdioxide te transformeren

- Spanning en corrosie ontkoppelen om metaalfalen te voorspellen

- Een vereenvoudigd nieuw proces zet houtafval uit landbouw en bosbeheer om in ethanol

- Een nieuwe manier om verspild methaan te benutten
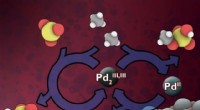
- Efficiënte methode voor fotokatalytische fluoralkyleringen van (hetero)arenen
 Binnenplaatsbepaling via een draadloos netwerk
Binnenplaatsbepaling via een draadloos netwerk Verschil tussen lithium- en alkalinebatterijen
Verschil tussen lithium- en alkalinebatterijen  Decomposer Fungi zijn voorbeelden van A?
Decomposer Fungi zijn voorbeelden van A?  Wat is de stabiele staat van een ster?
Wat is de stabiele staat van een ster?  Het bleken van koraalriffen laat ernstige veranderingen in de oceaancirculatie zien
Het bleken van koraalriffen laat ernstige veranderingen in de oceaancirculatie zien  Versnelde botafbraak in de afgelopen 70 jaar in het beroemde Mesolithische veenmoeras in gevaar
Versnelde botafbraak in de afgelopen 70 jaar in het beroemde Mesolithische veenmoeras in gevaar Lockdown keert terug:sommigen vragen zich af hoe ver coronavirusmaatregelen kunnen gaan voordat ze mensenrechten schenden
Lockdown keert terug:sommigen vragen zich af hoe ver coronavirusmaatregelen kunnen gaan voordat ze mensenrechten schenden Ontdekking op bloemenbegraafplaats kan mysterie van Neanderthaler-doodrituelen ontrafelen
Ontdekking op bloemenbegraafplaats kan mysterie van Neanderthaler-doodrituelen ontrafelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

