
Wetenschap
Welke heeft een grotere aantrekkingskracht voor elektronenfluor of zuurstof?
Dit is waarom:
* elektronegativiteit: Fluor heeft de hoogste elektronegativiteit van alle elementen (4,0 op de Pauling -schaal). Elektronegativiteit is een maat voor het vermogen van een atoom om elektronen in een binding aan te trekken. Zuurstof heeft een hoge elektronegativiteit (3,44), maar deze is nog steeds lager dan fluor.
* Effectieve nucleaire lading: Fluor heeft een kleinere atoomradius dan zuurstof. Dit betekent dat de elektronen dichter bij de kern zijn en een sterkere aantrekkingskracht van de positief geladen protonen ervaren. Deze sterkere attractie wordt effectieve nucleaire lading genoemd.
In eenvoudige bewoordingen, fluor "wil" elektronen sterker dan zuurstof vanwege zijn hogere elektronegativiteit en sterkere trek van zijn kern. Dit is de reden waarom fluor het meest reactieve niet-metaalelement is en zeer sterke bindingen vormt.
 Ingenieurs krijgen grip op gladde oppervlakteactieve stoffen
Ingenieurs krijgen grip op gladde oppervlakteactieve stoffen Wat voor soort dingen zijn gemaakt van calciet?
Wat voor soort dingen zijn gemaakt van calciet?  Winnaars van een wedstrijd van $ 20 miljoen maken beton om koolstofdioxide op te vangen
Winnaars van een wedstrijd van $ 20 miljoen maken beton om koolstofdioxide op te vangen Welke chemische reactie wordt gebruikt om macromoleculen zoals polypeptiden en zetmeel te synthetiseren?
Welke chemische reactie wordt gebruikt om macromoleculen zoals polypeptiden en zetmeel te synthetiseren?  Waar komen de stoffen in oplossing oceanen vandaan?
Waar komen de stoffen in oplossing oceanen vandaan?
 Wetenschappers kweken hazelnoten als het volgende geldgewas voor boeren in het Midwesten
Wetenschappers kweken hazelnoten als het volgende geldgewas voor boeren in het Midwesten 2020 evenaart 2016 als warmste jaar ooit
2020 evenaart 2016 als warmste jaar ooit 15, 000 wetenschappers in 184 landen waarschuwen voor negatieve wereldwijde milieutrends
15, 000 wetenschappers in 184 landen waarschuwen voor negatieve wereldwijde milieutrends Gigantische ijsberg klaar om af te breken van Antarctica:wetenschappers
Gigantische ijsberg klaar om af te breken van Antarctica:wetenschappers Waarom is fotosynthese belangrijk voor alle organismen?
Waarom is fotosynthese belangrijk voor alle organismen?
Hoofdlijnen
- Een kenmerk van het spijsverteringsepitheel dat het expansieorgaan ondersteunt, is de aanwezigheid van?
- Wat zijn drie dingen die een bloem maakt om het zaden te huisvesten?
- Hoe planten de fotosynthese beschermen tegen zuurstof
- Noem twee methoden die door fokkers worden gebruikt om de mutatiesnelheid te verhogen?
- Hoe vetcellen werken
- Wat zijn twee manieren waarop wetenschappers informatie verzamelen?
- Welke celstructuren worden aangetroffen in plantencellen die geen dierlijke cellen?
- UA maakt deel uit van een groep die ontrafelt hoe de hersenen het geheugen beheren
- Welk kenmerk delen alle leden van een soort?
- Vermindering van het corrosieve effect van gesmolten zouten

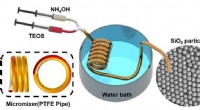
- Wetenschappers gebruiken een teflonpijp om een goedkope, eenvoudige reactor voor de synthese van silicadeeltjes
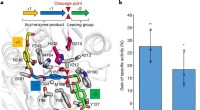
- Ontwikkeld enzym dat PET in tien uur kan afbreken
- Objecten printen die levende organismen kunnen bevatten

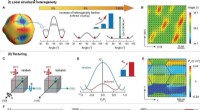
- Ultrahoge piëzo-elektrische prestaties aangetoond in keramische materialen
 Welk percentage mensen gebruikt zonne -energie?
Welk percentage mensen gebruikt zonne -energie?  Hoe paardenkracht omzetten in stuwkracht
Hoe paardenkracht omzetten in stuwkracht  Op welke locatie smelt rots mogelijk voor de vorming van Igneuss?
Op welke locatie smelt rots mogelijk voor de vorming van Igneuss?  Het ontsluiten van melkformule kan levens redden, zeggen wetenschappers
Het ontsluiten van melkformule kan levens redden, zeggen wetenschappers Naar een grotere MRI-gevoeligheid door gebruik te maken van kwantumhyperpolarisatie
Naar een grotere MRI-gevoeligheid door gebruik te maken van kwantumhyperpolarisatie RFID-tagarrays volgen lichaamsbewegingen, vorm verandert
RFID-tagarrays volgen lichaamsbewegingen, vorm verandert Is het onmogelijk om op Jupiter te landen?
Is het onmogelijk om op Jupiter te landen?  Wetenschappers observeren voor het eerst katalysator tijdens Fischer-Tropsch-synthese
Wetenschappers observeren voor het eerst katalysator tijdens Fischer-Tropsch-synthese
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

