
Wetenschap
Welke elementen reageren met aluminium om de dichtstbijzijnde edelgassen te worden?
1. Aluminium's elektronenconfiguratie
Aluminium (AL) heeft een atoomnummer van 13, wat betekent dat het 13 elektronen heeft. De elektronenconfiguratie is:
* 1S² 2S² 2P⁶ 3S² 3P¹
2. Het dichtstbijzijnde edelgas
Het dichtstbijzijnde edelgas naar aluminium is argon (ar) , die een elektronenconfiguratie heeft van:
* 1S² 2S² 2P⁶ 3S² 3P⁶
3. Een edelgasconfiguratie bereiken
Aluminium moet 3 elektronen krijgen om dezelfde elektronenconfiguratie te hebben als argon. Om dit te doen, vormt het meestal ionische bindingen met niet -metalen, waardoor zijn 3 valentie -elektronen weggeeft.
4. Elementen die reageren met aluminium
Hier zijn enkele veel voorkomende elementen die reageren met aluminium om ionische verbindingen te vormen, waardoor aluminium een stabiele edelgasconfiguratie kan bereiken:
* halogenen (groep 17): Fluor (F), chloor (CL), broom (Br), jodium (i)
* zuurstof (O): Aluminiumoxide (al₂o₃)
* zwavel (s): Aluminium sulfide (Al₂s₃)
Voorbeeld:
Wanneer aluminium reageert met chloor, vormt dit aluminiumchloride (alcl₃).
* al (3 valentie -elektronen) + 3cl (7 valentie -elektronen elk) → alcl₃
* Aluminium verliest zijn 3 valentie -elektronen en wordt een +3 ion (Al³⁺).
* Elk chlooratoom krijgt één elektron en wordt -1 -ionen (CL⁻).
* De resulterende verbinding heeft een neutrale lading en aluminium heeft een edelgasconfiguratie zoals argon bereikt.
Belangrijke opmerking: Hoewel aluminium de neiging heeft ionische verbindingen te vormen, kan het ook covalente bindingen vormen met elementen zoals koolstof in verbindingen zoals aluminiumcarbide (Al₄c₃).
 Programmeerbare swarmbots helpen bij het maken van flexibele biologische hulpmiddelen
Programmeerbare swarmbots helpen bij het maken van flexibele biologische hulpmiddelen Atomen in actie vangen:kijken naar next-gen materialen kristalliseren
Atomen in actie vangen:kijken naar next-gen materialen kristalliseren Water Polariteitsexperimenten
Water Polariteitsexperimenten  Wat is rode fosfor?
Wat is rode fosfor?  Hoeveel fasen zijn aanwezig in een mengsel van waterzand en olie. Kunt u dit scheiden in individuele stoffen?
Hoeveel fasen zijn aanwezig in een mengsel van waterzand en olie. Kunt u dit scheiden in individuele stoffen?
 Hoe heet het als al het land op aarde collectief?
Hoe heet het als al het land op aarde collectief?  Wat is het biome met de grootste biodiversiteit?
Wat is het biome met de grootste biodiversiteit?  Vulkanen een altijd aanwezige, als gewoonlijk gevaar op afstand
Vulkanen een altijd aanwezige, als gewoonlijk gevaar op afstand Nieuwe AI-app voorspelt stress door klimaatverandering voor boeren in Afrika
Nieuwe AI-app voorspelt stress door klimaatverandering voor boeren in Afrika We kunnen de lucht niet ruiken of proeven, maar we voelen waarom?
We kunnen de lucht niet ruiken of proeven, maar we voelen waarom?
Hoofdlijnen
- Is E coli een eencellige prokaryote -cel?
- Wat is synecologie?
- Welke twee factoren zou een bioloog moeten weten om een ecosysteem te identificeren?
- Wat veroorzaakt gisting?
- Onderzoek toont verschillen in energieverteerbaarheid tussen zeugen en gelten
- Wat zijn voorbeelden van halofielen?
- Hoe onderzoekers synthetische chromosomen sneller en goedkoper 'CREËREN'
- Wat zijn de vijanden van een Blauwe Morpho-vlinder?
- Waarom gebruiken wetenschappers verschillende methoden bij het onderzoeken van wetenschap?
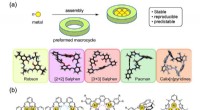
- Metaalcomplexen gemaakt van cyclische moleculen
- Bloed van drugsgebruikers kan herkomst van drugs onthullen

- Wetenschappers vinden moleculaire vernietigingscode voor enzym dat betrokken is bij cholesterolproductie

- Vloeistoffen tot het uiterste drijven met simulatiemethoden voor materialen van de volgende generatie
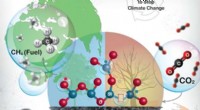
- De koolstofkringloop sluiten om klimaatverandering te stoppen
 3D-printen van uw eigen tractorstraal-levitatieapparaat
3D-printen van uw eigen tractorstraal-levitatieapparaat  Hoe wordt de wetenschap van de bergen genoemd?
Hoe wordt de wetenschap van de bergen genoemd?  Schakelaar met één atoom laadt fluorescerende kleurstoffen op
Schakelaar met één atoom laadt fluorescerende kleurstoffen op Record-setting ruimtewandeling eindigt met antenne op verkeerde plek
Record-setting ruimtewandeling eindigt met antenne op verkeerde plek Wiskundig model verklaart waarom sommige bacteriën zelfs in kleine doses ziekten veroorzaken
Wiskundig model verklaart waarom sommige bacteriën zelfs in kleine doses ziekten veroorzaken  Deze nieuwe ontwikkeling kan eindelijk de sleutel zijn tot ruimteliften
Deze nieuwe ontwikkeling kan eindelijk de sleutel zijn tot ruimteliften  Heeft Sprite er koolstofdioxide in?
Heeft Sprite er koolstofdioxide in?  Hoe werken aanraakgevoelige lampen?
Hoe werken aanraakgevoelige lampen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

