
Wetenschap
Hoe zou het verhogen van de temperatuurinfactsnelheid van een reactie?
* Verhoogde kinetische energie: Hogere temperaturen betekenen dat moleculen meer kinetische energie hebben, sneller bewegen en vaker botsen.
* Meer succesvolle botsingen: Vaker botsingen vergroten de kansen op succesvolle botsingen, die botsingen zijn met voldoende energie om de activeringsenergiebarrière te overwinnen en producten te vormen.
* Activeringsenergie: De activeringsenergie is de minimale energie die nodig is om een reactie te laten optreden. Hogere temperaturen bieden meer moleculen met voldoende energie om deze drempel te bereiken.
Hier is een vereenvoudigde analogie:
Stel je voor dat je probeert een kei bergop te rollen. De kei vertegenwoordigt de reactanten en de heuvel vertegenwoordigt de activeringsenergie. Als je de kei zachtjes duwt (lage temperatuur), komt het misschien niet over de heuvel. Maar als je het met meer kracht duwt (hogere temperatuur), is het waarschijnlijker om de heuvel te bereiken en de andere kant te bereiken (producten).
Belangrijke overwegingen:
* Beoordeel wet: Het specifieke effect van temperatuur op een reactiesnelheid wordt beschreven door de Arrhenius -vergelijking.
* katalysator: Katalysatoren versnellen de reacties door de activeringsenergie te verlagen, zodat ze een ander effect hebben dan de temperatuur.
* evenwicht: Hoewel temperatuur de snelheid van zowel voorwaartse als omgekeerde reacties verhoogt, kan het het evenwichtspunt van een omkeerbare reactie verschuiven.
Samenvattend: Het verhogen van de temperatuur versnelt in het algemeen de chemische reacties door de frequentie en het succespercentage van botsingen tussen reactantmoleculen te verhogen.
 Wat zijn de elementen in mengstaal?
Wat zijn de elementen in mengstaal?  Wetenschappers gebruiken chemische hulpmiddelen om kankerverwekkende eiwitten op te sporen
Wetenschappers gebruiken chemische hulpmiddelen om kankerverwekkende eiwitten op te sporen Wat is de netto ionische vergelijking voor Na H2O?
Wat is de netto ionische vergelijking voor Na H2O?  Een oplossing bevat 30 g calciumchloride in 250 water die de massapercentage uitdrukt?
Een oplossing bevat 30 g calciumchloride in 250 water die de massapercentage uitdrukt?  Hoe geleiden koper en zink elektriciteit?
Hoe geleiden koper en zink elektriciteit?
Hoofdlijnen
- Hoe wordt Unakite gevormd?
- Hoe een celvorm zijn functie beïnvloedt
- Vegetatieve lichamen van de meeste schimmels zijn?
- Hoe verandert een verhouding van oppervlakte -oppervlak tot volume naarmate de cel groter wordt?
- Hoe DNA 'proofreader'-eiwitten hun leesmateriaal kiezen en bewerken
- Wat is de naam van uit dierlijke polysachariden samengestelde glucose-eenheden?
- Hoe bacteriën spuiten maken:wetenschappers reconstrueren het bacteriële transportkanaal in reageerbuisjes
- Wat gebeurt er in anafase 1?
- De weg die niet is ingeslagen:leiden stressspecifieke mutaties verschillende evolutionaire paden?
- Structuur van het actieve ingrediënt bismut in Pepto-Bismol onthuld
- Legeronderzoek kijkt naar parels voor aanwijzingen voor het verbeteren van lichtgewicht bepantsering voor soldaten

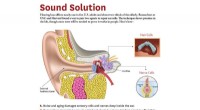
- Het verbinden van hoorhulpmoleculen met het oorbeen
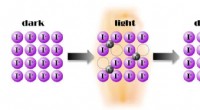
- Lichtgestuurd stroomtransport door geladen atomen voor het eerst gedemonstreerd
- Als A.I. had een brein - ingenieurs modelleren een kunstmatige synaps naar het menselijk brein

 Wat veroorzaakt zwaartekracht op aarde?
Wat veroorzaakt zwaartekracht op aarde?  Wat is polymeermengen?
Wat is polymeermengen?  Wat is het gewicht van een stipstof in kg?
Wat is het gewicht van een stipstof in kg?  Spionnen in een celkern sluipen
Spionnen in een celkern sluipen Maak een lijst van de top 5 natuurlijke hulpbronnen
Maak een lijst van de top 5 natuurlijke hulpbronnen Als een golf lage frequentie heeft, hoe beschrijft u de lengte?
Als een golf lage frequentie heeft, hoe beschrijft u de lengte?  Hoe klimaatverandering ecosystemen ontwricht
Hoe klimaatverandering ecosystemen ontwricht  10 kwaadaardige robots die de mensheid willen vernietigen
10 kwaadaardige robots die de mensheid willen vernietigen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

