
Wetenschap
Is lithium reactiever dan koper?
* Elektrochemische serie: Lithium staat bovenaan de elektrochemische serie, wat aangeeft dat het een sterke neiging heeft om elektronen te verliezen en positieve ionen te vormen. Koper daarentegen zit lager, wat betekent dat het een zwakkere neiging heeft om elektronen te verliezen.
* elektronegativiteit: Lithium heeft een lagere elektronegativiteit dan koper. Dit betekent dat lithium eerder elektronen opgeeft om positieve ionen te vormen, waardoor het reactiever wordt.
* ionisatie -energie: Lithium heeft een lagere ionisatie -energie dan koper, wat betekent dat het minder energie vereist om een elektron uit een lithiumatoom te verwijderen. Dit maakt het lithium meer vatbaar voor het reageren en het vormen van ionen.
Bewijs van reactiviteit:
* reactie met water: Lithium reageert heftig met water en produceert waterstofgas en lithiumhydroxide. Koper reageert niet met water bij kamertemperatuur.
* reactie met lucht: Lithium reageert gemakkelijk met zuurstof in de lucht en vormt lithiumoxide. Koper reageert alleen met zuurstof bij hoge temperaturen en vormt koperoxide.
Conclusie:
Vanwege zijn lagere elektronegativiteit, lagere ionisatie -energie en hogere positie in de elektrochemische serie, is lithium aanzienlijk reactiever dan koper.
 wat is de hardheid van veldspaat?
wat is de hardheid van veldspaat?  Wat is de chemische vergelijking voor een niet-lichtgevende vlam?
Wat is de chemische vergelijking voor een niet-lichtgevende vlam?  Wat is loodnitraat en ammoniumsulfaat?
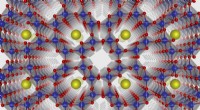
Wat is loodnitraat en ammoniumsulfaat?  Een niet-equivalente co-gedoteerde strategie om de elektrische eigenschappen van piëzo-elektrische keramiek te verbeteren
Een niet-equivalente co-gedoteerde strategie om de elektrische eigenschappen van piëzo-elektrische keramiek te verbeteren  Wat zijn enkele voorbeelden van corrosie?
Wat zijn enkele voorbeelden van corrosie?
 Studie verduidelijkt de langzame nutriëntenkringloop in Arctische bodems
Studie verduidelijkt de langzame nutriëntenkringloop in Arctische bodems Kunnen computerspellen boeren helpen zich aan te passen aan klimaatverandering?
Kunnen computerspellen boeren helpen zich aan te passen aan klimaatverandering? Canada bereidt zich voor op een nieuw seizoen met explosieve bosbranden
Canada bereidt zich voor op een nieuw seizoen met explosieve bosbranden  Zwarte truffel uit de Perigord voor het eerst gekweekt in het VK
Zwarte truffel uit de Perigord voor het eerst gekweekt in het VK Effecten van regenwater
Effecten van regenwater
Hoofdlijnen
- Probiotica (vriendelijke bacteriën): wat is het en hoe helpt het ons?
- Gekruiste (evolutionaire) signalen?
- Hoe wordt vaccinatie gemaakt?
- Hoe genetische doping werkt
- Hoe heet een vorm van plant?
- Een nieuwe strategie die door Helicobacter pylori wordt gebruikt om mitochondriën aan te pakken
- Hoe gebruiken organismen thermiek?
- Welke bloedgroep is altijd heterozygoot?
- Wetenschappers ontdekken methode om voedselverspilling om te zetten in biobrandstoffen
- Zelfassemblage van polypeptiden geleid door toevoeging van co-oplosmiddelen

- Gevouwen papier creëert een draagbaar laboratorium voor veldlaboratoriumtests
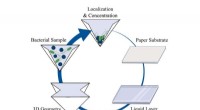
- Meer dan de som der delen
- NRL pigmentpakket voor schepen vertraagt verkleuring, verlaagt de belasting van de zonnetemperatuur

- Word wakker en ruik de koffie:onderzoek toont aan dat bevriezing van bonen het aroma kan behouden

 Nieuwe explosie bij St. Vincent vulkaan; cruiseschip helpt evacués
Nieuwe explosie bij St. Vincent vulkaan; cruiseschip helpt evacués Lucky Tetrachromats Zie de wereld met tot 100 miljoen kleuren
Lucky Tetrachromats Zie de wereld met tot 100 miljoen kleuren  Wat is een evenwichtige vergelijking voor synthese?
Wat is een evenwichtige vergelijking voor synthese?  Waarom wordt de zon overwogen en geen ster?
Waarom wordt de zon overwogen en geen ster?  Wat is een ijzige trog en hoe vormt het?
Wat is een ijzige trog en hoe vormt het?  Wie heeft de Mars Pathfinder gebouwd?
Wie heeft de Mars Pathfinder gebouwd?  Als je omhoog kijkt, hoe ver terug in de tijd zie je dan?
Als je omhoog kijkt, hoe ver terug in de tijd zie je dan?  Samenzweringsovertuigingen kunnen de politieke betrokkenheid in de buitenwijken vergroten, toont nieuwe studie
Samenzweringsovertuigingen kunnen de politieke betrokkenheid in de buitenwijken vergroten, toont nieuwe studie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

