
Wetenschap
Is water een goed oplosmiddel omdat de elektronen gelijk worden gedeeld?
* Polariteit is de sleutel: Water is een polaire molecuul. Dit betekent dat de elektronen in het molecuul niet gelijk worden gedeeld tussen de zuurstof- en waterstofatomen. Zuurstof is elektronegatiefer, wat betekent dat het elektronen sterker aantrekt, wat leidt tot een gedeeltelijke negatieve lading op het zuurstofatoom en gedeeltelijke positieve ladingen op de waterstofatomen.
* waterstofbinding: Met deze polariteit kunnen watermoleculen sterke waterstofbindingen vormen met andere polaire moleculen. Deze bindingen zijn de belangrijkste reden waarom water zo'n goed oplosmiddel is.
* oplossend proces: Wanneer een polaire stof (zoals zout) in water wordt opgelost, omringen de watermoleculen de ionen (zoals natrium en chloride) en trekken ze uit elkaar, waardoor de ionische bindingen worden verbroken. De gedeeltelijk negatieve zuurstofatomen van water trekken de positieve ionen aan, terwijl de gedeeltelijk positieve waterstofatomen de negatieve ionen aantrekken.
Samenvattend: Water's vermogen om veel stoffen op te lossen is te wijten aan de polariteit en het vermogen om waterstofbindingen te vormen , niet omdat de elektronen gelijk worden gedeeld.
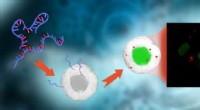
 Wetenschappers maken een atomair lijmpistool om betere nucleïnezuurtherapieën te bouwen
Wetenschappers maken een atomair lijmpistool om betere nucleïnezuurtherapieën te bouwen Wat is chemische formule voor stannic hypoiodiet?
Wat is chemische formule voor stannic hypoiodiet?  Waarom ontstaat er water als waterstof verbrand wordt?
Waarom ontstaat er water als waterstof verbrand wordt?  Wat zijn de elementen in ijzerfyrofosfaat?
Wat zijn de elementen in ijzerfyrofosfaat?  Is zure regen gemaakt van kleine hoeveelheden azijnzuur en carbonzuren?
Is zure regen gemaakt van kleine hoeveelheden azijnzuur en carbonzuren?
 Is het jagen op wolven de sleutel tot hun behoud?
Is het jagen op wolven de sleutel tot hun behoud?  Welke kenmerken delen bijen en mieren?
Welke kenmerken delen bijen en mieren?  Nieuwe index laat zien dat door de mens veroorzaakte opwarming van de aarde sneller gaat dan ooit
Nieuwe index laat zien dat door de mens veroorzaakte opwarming van de aarde sneller gaat dan ooit Minder koeien, meer bomen en bio-energie
Minder koeien, meer bomen en bio-energie Wetenschappers racen om te voorkomen dat de koraalriffen ter wereld verdwijnen
Wetenschappers racen om te voorkomen dat de koraalriffen ter wereld verdwijnen
Hoofdlijnen
- Wat is de selectie door mensen voor het fokken van nuttige eigenschappen van natuurlijke variatie tussen verschillende organismen?
- Wat is het geleidende celtype in Phloem?
- Welk proces reproduceren bacteriën seksueel?
- Wat is de wetenschappelijke definitie van een virus?
- Wat is de functie van eenvoudig kolomvormig epitheel?
- Wat zijn de twee belangrijkste functies van nucleïnezuur in levende wezens?
Nucleïnezuren zijn kleine stukjes materie met grote rollen om te spelen. Genoemd naar hun locatie - de kern - deze zuren dragen informatie die cellen helpt bij het maken va
- Welke twee stoffen heeft een foetus nodig om volledig potentieel te groeien?
- Opinie:Waarom bioplastics onze plasticproblemen niet zullen oplossen
- Hoe een klein en vreemd zeedier gedurende zijn hele leven onbeperkt sperma produceert
- Doorbraak voor het volgen van RNA met fluorescentie
- Wetenschappers bouwen microporeuze MOF-vallen voor het verminderen van giftige gassen
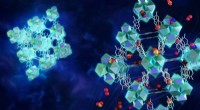
- Metalen organische kaders metalen meesterschap

- Hogesnelheidsfilm helpt wetenschappers bij het ontwerpen van gloeiende moleculen

- Energiezuinige groene route naar magnesiumproductie

 Bouwden een 1, 300 km lang ondergronds wetenschappelijk experiment om 's werelds meest ongrijpbare deeltjes te bestuderen
Bouwden een 1, 300 km lang ondergronds wetenschappelijk experiment om 's werelds meest ongrijpbare deeltjes te bestuderen Hoe vliegtuigen werken
Hoe vliegtuigen werken  Hoe u op uw instinct kunt vertrouwen om phishing-aanvallen af te weren
Hoe u op uw instinct kunt vertrouwen om phishing-aanvallen af te weren Frequentie van deltagolven in slaapstudie
Frequentie van deltagolven in slaapstudie Moon Express onthult plannen voor privé-verkenning van de maan
Moon Express onthult plannen voor privé-verkenning van de maan Natuurkundigen veranderen een kristal in een elektrisch circuit
Natuurkundigen veranderen een kristal in een elektrisch circuit Duurzaam beleggen:hoe effectief is het eigenlijk?
Duurzaam beleggen:hoe effectief is het eigenlijk?  Welke cellen hebben procaryots en eucarotisch?
Welke cellen hebben procaryots en eucarotisch?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

