
Wetenschap
Hoe stelde Dalton zich het atoom voor?
Hier is een uitsplitsing van zijn belangrijkste ideeën:
* ondeelbaar en onverwoestbaar: Dalton geloofde dat atomen niet in kleinere deeltjes konden worden afgebroken.
* unieke eigenschappen: Elk element was samengesteld uit identieke atomen met specifieke eigenschappen, zoals massa, grootte en reactiviteit.
* Combineren in gehele getalverhoudingen: Wanneer elementen gecombineerd om verbindingen te vormen, deden ze dit in eenvoudige, hele aantal verhoudingen (de wet van meerdere verhoudingen).
Zijn model was gebaseerd op:
* waarnemingen van chemische reacties: Dalton merkte op dat elementen altijd gecombineerd in vaste verhoudingen, wat suggereert dat discrete eenheden.
* De wet van het behoud van massa: Massa wordt niet gecreëerd of vernietigd in chemische reacties.
* De wet van duidelijke verhoudingen: Een gegeven chemische verbinding bevat altijd dezelfde elementen in dezelfde verhouding door massa.
Beperkingen van het model van Dalton:
* Geen interne structuur: Het model van Dalton was geen rekening gehouden met de subatomaire deeltjes (protonen, neutronen en elektronen) die later werden ontdekt.
* Vereenvoudigde weergave: Het verklaarde de verschillende chemische eigenschappen van elementen niet.
Ondanks zijn beperkingen was het model van Dalton een belangrijke doorbraak in ons begrip van materie. Het bood een fundamenteel kader voor verdere ontwikkeling van atoomtheorie.
 Hoe te Galvaniseren Pewter
Hoe te Galvaniseren Pewter Als calciummetaal wordt blootgesteld aan chloorgas, treedt een reactie op, wat zal het product (en) van deze reactie zijn?
Als calciummetaal wordt blootgesteld aan chloorgas, treedt een reactie op, wat zal het product (en) van deze reactie zijn?  Is het niet reageren op een fysische of chemische stof?
Is het niet reageren op een fysische of chemische stof?  Hoe reageert rhyoliet op zuur?
Hoe reageert rhyoliet op zuur?  Snelle oppervlaktedynamiek maakte koude verbinding van metalen glazen mogelijk
Snelle oppervlaktedynamiek maakte koude verbinding van metalen glazen mogelijk
 Schadelijke algenbloei wordt detecteerbaar langs het westelijke Eriemeer
Schadelijke algenbloei wordt detecteerbaar langs het westelijke Eriemeer Onderzoekers onthullen hoe uitgestorven Stellers zeekoe kelpbossen vormden
Onderzoekers onthullen hoe uitgestorven Stellers zeekoe kelpbossen vormden  De levende delen van een ecosysteem worden genoemd welke factoren?
De levende delen van een ecosysteem worden genoemd welke factoren?  natte winter, lente verlichten droogte in staat
natte winter, lente verlichten droogte in staat Eerste studie in zijn soort kwantificeert de effecten van politiek lobbyen op de waarschijnlijkheid van uitvoering van klimaatbeleid
Eerste studie in zijn soort kwantificeert de effecten van politiek lobbyen op de waarschijnlijkheid van uitvoering van klimaatbeleid
Hoofdlijnen
- Wat betekent BIOTC?
- Wat microben ons kunnen vertellen over het leven op aarde en in de ruimte
- Beschrijf en geef een voorbeeld van twee symbiotische relaties die zich voordoen tussen populaties in een gemeenschap?
- Evolutionair gewasonderzoek:Egoplanten geven lagere opbrengst
- Wat is bacteriële spore?
- Wat is een chromosoom?
- Wat is een gelijkenis tussen haploïde en diploïde?
- Hoe de zwarte rat Europa koloniseerde in de Romeinse en middeleeuwse periode
- Wanneer cellen afbreken welke elektrolyt verloren gaat uit de cel?
- Chemici identificeren de structuur van het middel dat mutaties veroorzaakt in embryo's van koraalduivels
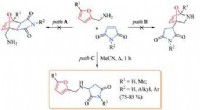
- Zeer efficiënte maliënkolderkatalysatoren ontwikkeld voor ontkoppelde waterelektrolyse
- Onderzoeker creëert chemisch systeem dat vroeg celgedrag nabootst

- Scholen moleculaire vissen kunnen beeldschermen verbeteren

- Selectieve oplossing van elementair goud uit multimetaalbronnen in organische oplossingen

 Californië negeert plannen voor hogesnelheidslijn LA-SF
Californië negeert plannen voor hogesnelheidslijn LA-SF Bijna 300 bosbranden in Siberië te midden van recordwarm weer
Bijna 300 bosbranden in Siberië te midden van recordwarm weer Wat veroorzaakt de vervorming van licht van sterren die betekenen dat we ze twinkelen zien?
Wat veroorzaakt de vervorming van licht van sterren die betekenen dat we ze twinkelen zien?  Verre planeetsystemen hebben de vorm van het zonnestelsel
Verre planeetsystemen hebben de vorm van het zonnestelsel Hoe worden nieuwe sterren gevormd in de enorme uitgestrektheid van het heelal?
Hoe worden nieuwe sterren gevormd in de enorme uitgestrektheid van het heelal?  Welk aldehyde is afgeleid van ethaan?
Welk aldehyde is afgeleid van ethaan?  Wat komt er na een nevel?
Wat komt er na een nevel?  Wat is de grootte of diameter van Star Betelgeuse?
Wat is de grootte of diameter van Star Betelgeuse?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

