
Wetenschap
Materialen met obligaties delen elektronen gelijkmatig terwijl die ongelijk en hebben een dipoolmoment?
Niet -polaire covalente bindingen:
* elektronen worden gelijk gedeeld: De atomen die bij de binding betrokken zijn, hebben een vergelijkbare elektronegativiteit (het vermogen om elektronen aan te trekken). Dit betekent dat geen van beide Atom de gedeelde elektronen dichter bij zichzelf trekt.
* Geen dipoolmoment: Omdat de elektronen gelijkmatig worden verdeeld, is er geen scheiding van lading en daarom geen dipoolmoment (een maat voor de scheiding van positieve en negatieve ladingen).
Polaire covalente bindingen:
* elektronen worden ongelijk gedeeld: De atomen die bij de binding betrokken zijn, hebben verschillende elektronegativiteiten. Het atoom met hogere elektronegativiteit trekt de gedeelde elektronen dichterbij, waardoor een gedeeltelijke negatieve lading op dat atoom en een gedeeltelijke positieve lading op het andere atoom ontstaat.
* Dipoolmoment: De ongelijke verdeling van elektronen creëert een scheiding van lading, wat resulteert in een dipoolmoment. Dit betekent dat het molecuul een positief einde en een negatief einde heeft.
Voorbeelden:
* nonpolar: Een molecuul zuurstof (O2) heeft een niet -polaire covalente binding omdat de twee zuurstofatomen dezelfde elektronegativiteit hebben.
* Polar: Een watermolecuul (H2O) heeft polaire covalente bindingen omdat zuurstof meer elektronegatief is dan waterstof, waardoor een gedeeltelijke negatieve lading op het zuurstofatoom en gedeeltelijke positieve ladingen op de waterstofatomen ontstaat.
Key Takeaway: De gelijke of ongelijke delen van elektronen in een covalente binding bepaalt of het niet -polair of polair is, met significante gevolgen voor de algemene eigenschappen van het molecuul.
 Vijf voorbeelden van zouten voor wetenschap Class
Vijf voorbeelden van zouten voor wetenschap Class Materialen kunnen leiden tot zelfherstellende smartphones
Materialen kunnen leiden tot zelfherstellende smartphones Wat betekent de term chemische binding?
Wat betekent de term chemische binding?  Een schriftelijke formule die het aantal atomen elk element in één titaniumdioxide uitdrukt?
Een schriftelijke formule die het aantal atomen elk element in één titaniumdioxide uitdrukt?  Woordvergelijking voor de reactie tussen calciumcarbonaat en methaanzuur?
Woordvergelijking voor de reactie tussen calciumcarbonaat en methaanzuur?
 Kan genderdiversiteit in raden van bestuur de sociale betrokkenheid en duurzaamheid van bedrijven verbeteren?
Kan genderdiversiteit in raden van bestuur de sociale betrokkenheid en duurzaamheid van bedrijven verbeteren?  Waarom de milieuwetenschap, inclusief de menselijke ecologie, de Rio+20-gesprekken moet aansturen
Waarom de milieuwetenschap, inclusief de menselijke ecologie, de Rio+20-gesprekken moet aansturen  Wat doen buizerds?
Wat doen buizerds?  Behoort het milieu hoofdzakelijk tot het menselijk ras?
Behoort het milieu hoofdzakelijk tot het menselijk ras?  Staten klagen EPA's aan om pesticide op de markt te houden
Staten klagen EPA's aan om pesticide op de markt te houden
Hoofdlijnen
- Wat zijn de 7 levensprocessen?
- Waarom groeit de wortel eerst?
- Kunnen bacteriën gedijen in een lage pH van een omgeving?
- Welk allel is de dominante van een Pea Plant P -generatie F1 of F2 -generatie?
- Wordt suiker opgeslagen in de wortel van uienplant?
- Wat is de betekenis van gemeenschappelijk laboratoriumapparatuur in de wetenschap?
- Waarom zouden wetenschappers een controlemonster gebruiken dat geen DNA heeft van Bighead Carp in EDNA -bewaking?
- Exon: definitie, functie en belang in RNA Splicing
- Wat is een kernenvelopmembraan?
- Een herbruikbare katalysator voor de synthese van esters
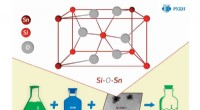
- Perfecte dranken en vloeibare voeding tot op moleculair niveau

- Scherp smakende substantie in gember vermindert slechte adem

- Nieuwe doelstelling voor ontwikkeling van innovatieve antibiotica
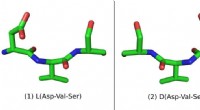
- Door de spiegel:nieuwe spiegelbeeldmoleculen kunnen leiden tot betere medicijnen
 Onderzoek laat zien hoe slijm microben temt
Onderzoek laat zien hoe slijm microben temt  Families uit 8 landen klagen EU aan wegens klimaatverandering
Families uit 8 landen klagen EU aan wegens klimaatverandering Hoe ver is de wereld van de zon?
Hoe ver is de wereld van de zon?  Hoeveel verschil maakt het aantal kinderen in een klaslokaal?
Hoeveel verschil maakt het aantal kinderen in een klaslokaal? Archeoloog zet tanden in het begrijpen van culturele identiteit, interacties in de oude Nijlvallei
Archeoloog zet tanden in het begrijpen van culturele identiteit, interacties in de oude Nijlvallei Hoe te verpakken om een ei te beschermen voor een wetenschapsproject?
Hoe te verpakken om een ei te beschermen voor een wetenschapsproject?  Herstel na rampen vereist wederopbouw van levensonderhoud
Herstel na rampen vereist wederopbouw van levensonderhoud Nanomaterialen zijn veelbelovend voor de productie van waterstof uit water
Nanomaterialen zijn veelbelovend voor de productie van waterstof uit water
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

