
Wetenschap
Door de spiegel:nieuwe spiegelbeeldmoleculen kunnen leiden tot betere medicijnen
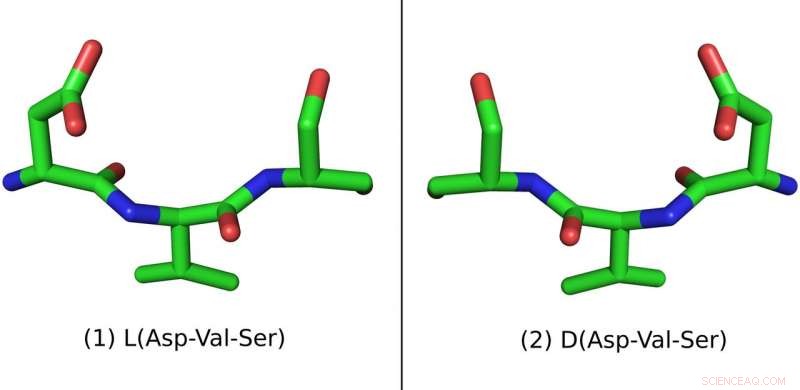
Dit peptide bestaat uit drie aminozuren:Asparaginezuur (Asp), Valine (Val) en Serine (Ser). De natuurlijke L-vorm is aan de linkerkant en de synthetische D-vorm is aan de rechterkant Credit:Pablo Gainza
Onderzoekers van de Universiteit van Toronto hebben een nieuwe technologie ontwikkeld voor het maken van duurzamere ziektebestrijdende moleculen die kunnen leiden tot medicijnen met een langduriger effect.
De spiegelbeeldversie van bestaande medicijnen zou langer in het lichaam blijven dankzij hun vermogen om afbraak door enzymen in de maag en de bloedbaan te voorkomen. Voor patiënten, dit zou betekenen dat er minder vaak drugs worden geïnjecteerd en dat er mogelijk meer medicijnen in de vorm van pillen beschikbaar komen.
Het ontwerpen van deze medicijnen was lastig, echter.
Nu een team van onderzoekers onder leiding van Philip Kim, een professor in computerwetenschappen en moleculaire genetica aan het Donnelly Centre for Cellular and Biomolecular Research van de Universiteit van Toronto, heeft een nieuwe technologie ontwikkeld voor het maken van spiegelbeeldpeptiden, die receptoren op het celoppervlak binden en activeren. Ze creëerden spiegelbeeldversies van blockbuster-geneesmiddelen glycogeen-achtig-peptide 1 (GLP1) en parathyroïdhormoon (PTH). GLP1 wordt veel gebruikt om diabetes te behandelen, en PTH is een behandeling voor hypoparathyreoïdie, een aandoening waarbij het lichaam te weinig PTH produceert en de spierfunctie beïnvloedt, en osteoporose. Beide tegenhangers in spiegelbeeld hadden langere effecten op cellen dan de bestaande medicijnen.
De bevindingen worden beschreven in de vroege online editie van 29 januari van de Proceedings van de National Academy of Sciences .
"Spiegelbeeldpeptiden worden niet herkend en afgebroken door enzymen in de maag of bloedbaan en hebben daardoor een langdurig effect, " zegt Kim. Het andere voordeel, hij zei, is dat spiegelbeeldpeptiden ook over het hoofd worden gezien door het immuunsysteem, die vaak natuurlijke peptiden aanziet voor vreemde indringers en dus de werkzaamheid van geneesmiddelen beperkt.
Peptiden zijn gemaakt van moleculen die aminozuren worden genoemd. Om redenen die niet volledig worden begrepen en die teruggaan tot de oorsprong van het leven, bijna alle aminozuren in de natuurlijke wereld komen voor in één geometrische vorm. Hun atomen zijn zo gerangschikt dat het hele aminozuurmolecuul linkshandig lijkt, of "L" in het kort. Als resultaat, natuurlijke peptiden zijn ook linkshandig. Omdat peptiden geproduceerd door microben, planten en dieren kunnen schadelijk zijn, het menselijk lichaam heeft efficiënte manieren ontwikkeld om ze te zuiveren.
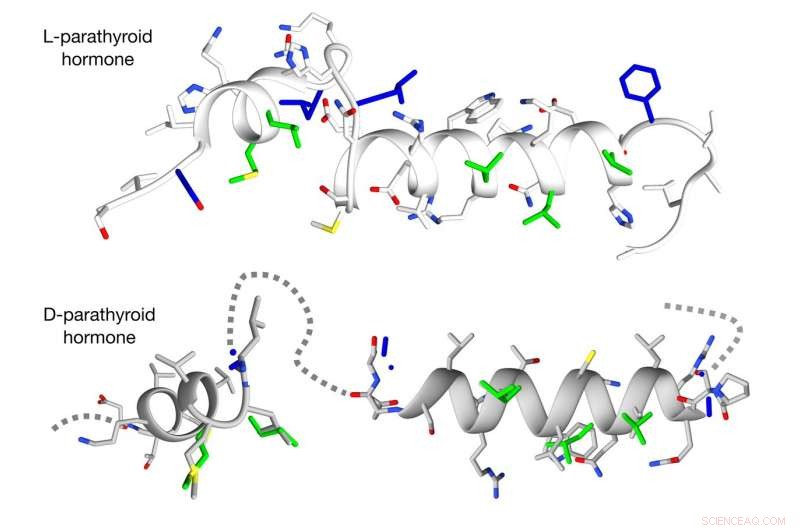
De nieuwe methode overwint obstakels bij het ontwerpen van D-versies van complexe spiraalvormige peptiden. Krediet:Michael Garton, Universiteit van Toronto
Maar als je de geometrische oriëntatie van een peptide omkeert, door er een spiegelbeeld van te maken, het kan nog steeds de juiste receptoren binden terwijl het ongemerkt langs de afweermechanismen van het lichaam glijdt. Spiegelbeeldpeptiden kunnen in het laboratorium worden gemaakt van synthetische rechtshandige aminozuren, die ook bekend staan als "D" voor rechtsdraaiend.
In tegenstelling tot rechte L-peptiden, die vrij eenvoudig kan worden omgezet in een D-vorm, de meeste biologisch actieve peptiden zijn in helices gedraaid, en tot nu toe is er geen goede manier geweest om hun spiegelbeeldige tegenhangers op grote schaal te ontwerpen, zei Kim.
Met behulp van een puur computationele benadering, Het team van Kim wist dit obstakel te overwinnen. Ze begonnen met de grootste openbare database die structurele informatie bevat voor drie miljoen helixvormige peptiden. Vervolgens creëerden ze een algoritme om deze peptiden om te zetten in hun D-tegenhangers. Eindelijk, het team zocht in deze nieuwe virtuele bibliotheek van spiegelbeeldpeptiden naar degenen die het beste overeenkwamen met GLP1 en PTH.
Toen ze de match hadden gevonden, de onderzoekers lieten de D-peptiden synthetiseren en testen op hun vermogen om hun receptoren op het celoppervlak te activeren. Ze ontdekten dat zowel D-GLP1 als D-PTH cellulaire reacties opwekten die vergelijkbaar waren met hun natuurlijke tegenhangers, maar een langduriger effect hadden.
"We onderzoeken nu of de D-PTH oraal kan worden toegediend omdat het afbraak in de maag voorkomt", zegt Kim. "Voor vaak gedoseerde medicatie, dit is van groot belang, omdat het nemen van een pil veel gemakkelijker is dan het krijgen van een injectie. Dit zou ertoe kunnen leiden dat veel meer peptidegeneesmiddelen als pillen worden ingenomen".
Momenteel, patiënten die GLP1 gebruiken die werd ontdekt aan de U of T door professor Daniel Drucker, van de afdeling geneeskunde, of PTH, moet deze medicijnen dagelijks injecteren.
Kim werkt samen met het U of T-octrooibureau om zijn technologie te beschermen terwijl hij mogelijkheden verkent om samen te werken met de farmaceutische industrie om het onderzoek te commercialiseren. Hij ontwikkelt ook spiegelbeeldversies van peptiden die werken tegen de Dengue- en Zika-virussen om ze duurzamer in de bloedbaan te maken.
"We testen onze aanpak op zoveel mogelijk interessante peptiden, ' zei Kim.
 Hoe Percentage vaste stoffen te berekenen per gewicht
Hoe Percentage vaste stoffen te berekenen per gewicht Nikkel in de schijnwerpers voor röntgenstraling
Nikkel in de schijnwerpers voor röntgenstraling Holografische bundelvorming om metallic 3D-printen een boost te geven
Holografische bundelvorming om metallic 3D-printen een boost te geven Duurzamere recycling van kunststoffen
Duurzamere recycling van kunststoffen Organische gaten-transporterende lagen met kleine moleculen naar efficiënte p-i-n perovskiet-zonnecellen
Organische gaten-transporterende lagen met kleine moleculen naar efficiënte p-i-n perovskiet-zonnecellen
 267 miljoen mensen wereldwijd lopen gevaar door zeespiegelstijging
267 miljoen mensen wereldwijd lopen gevaar door zeespiegelstijging Onderzoekers gebruiken wilde rijst om de gezondheid van de meren en beken van Minnesota te voorspellen
Onderzoekers gebruiken wilde rijst om de gezondheid van de meren en beken van Minnesota te voorspellen Aziatische inwoners worden blootgesteld aan negen keer meer luchtvervuiling dan Amerikanen of Europeanen
Aziatische inwoners worden blootgesteld aan negen keer meer luchtvervuiling dan Amerikanen of Europeanen Wat is het effect van de mens op het zoetwaterbiomeer?
Wat is het effect van de mens op het zoetwaterbiomeer?  Brachiopoden die bestand zijn tegen veranderingen in het milieu in het verleden
Brachiopoden die bestand zijn tegen veranderingen in het milieu in het verleden
Hoofdlijnen
- Hoe zijn bacteriën en plantencellen gelijk?
- Mongoolse microfossielen wijzen op de opkomst van dieren op aarde
- Wat zijn klaprozen?
- Chromosoomorganisatie komt voort uit 1-D-patronen
- Bacteriële virussen blijken interactie te hebben met menselijke cellen, studie vondsten
- Kikkers onthullen mechanisme dat de levensvatbaarheid van hybriden bepaalt
- Celstructuur van Nostoc
- Waarom is een atom elektrisch neutraal?
- Cellen puilen uit om door barrières te persen
- Onschadelijke elementen kunnen giftig lood in elektronica vervangen

- Bluspoeder hergebruikt in meststoffen en brandvertragers

- Hydrogel met langzame afgifte helpt immunotherapie voor kanker
- Eerste gedetailleerde blik op cruciaal enzym bevordert kankeronderzoek

- Verbeterde sterkte en taaiheid in een legering met hoge entropie via geordende zuurstofcomplexen
 Ultrasnelle en breedband perovskiet-fotodetectoren voor beeldvorming met groot dynamisch bereik
Ultrasnelle en breedband perovskiet-fotodetectoren voor beeldvorming met groot dynamisch bereik Overlevingsstrategie:hoe één enzym bacteriën helpt herstellen van blootstelling aan antibiotica
Overlevingsstrategie:hoe één enzym bacteriën helpt herstellen van blootstelling aan antibiotica Miljoenen getroffen in het ergste watertekort van Manilla
Miljoenen getroffen in het ergste watertekort van Manilla De energie-implicaties van organische radicaalpolymeren
De energie-implicaties van organische radicaalpolymeren Tijdperk
Tijdperk  Satelliet houdt het vakantieweer in de VS in de gaten
Satelliet houdt het vakantieweer in de VS in de gaten Jupiter:anatomie van een gasreus
Jupiter:anatomie van een gasreus  Wetenschappers maken atomair naadloos, dunst mogelijke halfgeleiderovergangen
Wetenschappers maken atomair naadloos, dunst mogelijke halfgeleiderovergangen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

