
Wetenschap
Waarom trekken niet -metalen elementen elektronen zo effectief op tijdens een reactie?
Hier is een uitsplitsing van waarom:
* elektronegativiteit: Dit is de maat voor het vermogen van een atoom om elektronen naar zichzelf aan te trekken binnen een chemische binding. Niet -metalen hebben een hogere elektronegativiteit vergeleken met metalen.
* Elektronenconfiguratie: Niet -metalen hebben meestal bijna volledige buitenste schalen van elektronen. Ze zijn stabieler wanneer ze elektronen krijgen om hun buitenschalen te voltooien. Deze sterke wens om een stabiele elektronenconfiguratie te bereiken, stimuleert hun aantrekkingskracht op elektronen.
* Nucleaire lading: Niet -metalen hebben een relatief kleine atoomradius en een hogere nucleaire lading. Deze sterke positieve lading in de kern trekt elektronen effectiever aan.
Hier is hoe het zich afspeelt in een reactie:
Wanneer een niet -metaal reageert met een metaal, doneert het metaalatoom zijn elektronen gemakkelijk aan het niet -metaal. Dit komt omdat het metaalatoom een lagere elektronegativiteit heeft en de voorkeur geeft om elektronen te verliezen om een stabiele elektronenconfiguratie te bereiken.
Voorbeelden:
* natrium (Na) en chloor (CL): Natrium, een metaal, heeft een lage elektronegativiteit en verliest gemakkelijk een elektron om een positief ion te vormen (Na+). Chloor, een niet-metaal, heeft een hoge elektronegativiteit en krijgt het elektron om een negatief ion te vormen (Cl-). Dit resulteert in de vorming van natriumchloride (NaCl) of tafelzout.
* zuurstof (O) en waterstof (H): Zuurstof, een niet -metaal, heeft een hogere elektronegativiteit dan waterstof. In water (H2O) trekt zuurstof elektronen sterker aan, wat leidt tot een polaire binding waarbij het zuurstofatoom een lichte negatieve lading heeft en de waterstofatomen een lichte positieve lading hebben.
In wezen zijn niet -metalen elektronen "hoarders" vanwege hun hoge elektronegativiteit en een sterke wens voor een stabiele elektronenconfiguratie. Dit maakt hen efficiënt in het aantrekken van elektronen tijdens chemische reacties.
 Waarom wordt de theoretische opbrengst van een reactie alleen bepaald door de hoeveelheid beperkende reactant?
Waarom wordt de theoretische opbrengst van een reactie alleen bepaald door de hoeveelheid beperkende reactant?  Veilig, efficiënte manier om waterstof te produceren uit aluminiumdeeltjes en water voor vliegtuigenergie tijdens de vlucht
Veilig, efficiënte manier om waterstof te produceren uit aluminiumdeeltjes en water voor vliegtuigenergie tijdens de vlucht Geminiaturiseerde massaspectrometer voor verkenning van Mars heeft een enorm potentieel
Geminiaturiseerde massaspectrometer voor verkenning van Mars heeft een enorm potentieel Waarom zijn koolstof-waterstofbindingen langer dan in?
Waarom zijn koolstof-waterstofbindingen langer dan in?  Wat is het kleinste deeltje van een element dat nog steeds dezelfde chemische eigenschappen heeft?
Wat is het kleinste deeltje van een element dat nog steeds dezelfde chemische eigenschappen heeft?
 NASA's Aqua Satellite vindt windschering die Omar . niet in de steek laat
NASA's Aqua Satellite vindt windschering die Omar . niet in de steek laat Lijst van zoogdieren in Tennessee
Lijst van zoogdieren in Tennessee Wat zijn de oorzaken van de vernietiging van het ecosysteem?
Wat zijn de oorzaken van de vernietiging van het ecosysteem?  Bacteriën in omgevingen met een ijzertekort verwerken selectief koolstofbronnen
Bacteriën in omgevingen met een ijzertekort verwerken selectief koolstofbronnen Onderzoekers identificeren 15 twisters die prairies raken op Canada Day
Onderzoekers identificeren 15 twisters die prairies raken op Canada Day
Hoofdlijnen
- Wat is de wetenschappelijke naam voor root haarcel?
- Een kungfu-kick leidde onderzoekers naar 's werelds oudste complete visfossielen. Dit is wat ze hebben gevonden
- Waar vindt de eiwitsynthese plaats?
- Wat zorgt ervoor dat vliegen aanvallen?
- Hoe planten hun partners kiezen en andere minnaars afstoten
- Bloedagar en chocolade zijn soorten verrijkte media die zeker remmen?
- Welk bioom bevindt zich in Canada en Rusland?
- Waarom papegaaien soms elkaars baby's adopteren (of doden)
- Wat voor soort wetenschapper gebruikt een beker?
- De kristalsymmetrie van de natuur onderbreken om gerichte medicijnafgifte te bevorderen
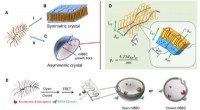
- Energiezuinige groene route naar magnesiumproductie

- Onderzoeken met neutronen beslechten wetenschappelijk geschil over de structuur van fluor

- Analyse van magnetische materialen was nog nooit zo begrijpelijk

- Aerogels voor zonne-apparaten en ramen
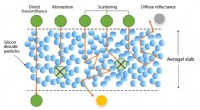
 Wat stelt een chemische formule voor?
Wat stelt een chemische formule voor?  Hoe de wandelende tak zichzelf blijft plakken (en weer losmaakt).
Hoe de wandelende tak zichzelf blijft plakken (en weer losmaakt).  Wat betekent de rechtszaak van Epic Games v. Apple voor iPhone-bezitters?
Wat betekent de rechtszaak van Epic Games v. Apple voor iPhone-bezitters? Wat zullen sommige stamcellen worden als ze rijpen tot erytrocyten?
Wat zullen sommige stamcellen worden als ze rijpen tot erytrocyten?  Waterstofeconomie met massaproductie van zeer zuivere waterstof uit ammoniak
Waterstofeconomie met massaproductie van zeer zuivere waterstof uit ammoniak Hoe huizen tegen natuurbranden te beschermen is het onderwerp van het nieuwe boek van de professor
Hoe huizen tegen natuurbranden te beschermen is het onderwerp van het nieuwe boek van de professor  Wetenschappers ontdekken fossielen van gigantische zeehagedis die 66 miljoen jaar geleden over de oceanen heerste
Wetenschappers ontdekken fossielen van gigantische zeehagedis die 66 miljoen jaar geleden over de oceanen heerste Kwantumnetwerk om onhackbare communicatie te testen
Kwantumnetwerk om onhackbare communicatie te testen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

