
Wetenschap
Welke gassen hebben de grootste snelheid van effusie?
Het gas met de laagste molaire massa zal de grootste snelheid van effusie hebben.
Dit is waarom:
* Graham's Law of Effusion: Deze wet stelt dat de snelheid van effusie van een gas omgekeerd evenredig is met de vierkantswortel van zijn molaire massa.
* Effusie: Dit is het proces van een gas dat door een klein gat in een vacuüm ontsnapt.
Voorbeeld:
Laten we helium (HE, molmassa =4 g/mol) en zuurstof (O2, molmassa =32 g/mol) vergelijken.
* Helium, met een lagere molaire massa, zal sneller uitzetten dan zuurstof.
Samenvattend: Hoe lichter het gasmolecuul (lagere molaire massa), hoe sneller het zal uitoefenen.
 Wat wordt gebruikt om verschillende fracties in ruwe olie te scheiden?
Wat wordt gebruikt om verschillende fracties in ruwe olie te scheiden?  Heeft zwavel een lage dichtheid?
Heeft zwavel een lage dichtheid?  In gaschromatografie is isotherm is wanneer de temperatuurconstante maar wat het wordt genoemd geprogrammeerd om te verhogen?
In gaschromatografie is isotherm is wanneer de temperatuurconstante maar wat het wordt genoemd geprogrammeerd om te verhogen?  Welke ester vormt wanneer ethylalcohol en mierenzuur reageren?
Welke ester vormt wanneer ethylalcohol en mierenzuur reageren?  Zijn jodium en water homogeen of heterogeen?
Zijn jodium en water homogeen of heterogeen?
 Hoe klimaatmodellering en -voorspelling te verbeteren?
Hoe klimaatmodellering en -voorspelling te verbeteren? Facebook, Google en Amazon te groot? Waarom die vraag steeds weer opduikt
Facebook, Google en Amazon te groot? Waarom die vraag steeds weer opduikt  Professor volgt middeleeuwse winden van (klimaat)verandering
Professor volgt middeleeuwse winden van (klimaat)verandering Versnelde temperatuurstijging in de Pyreneeën
Versnelde temperatuurstijging in de Pyreneeën Orkaan Ian zal naar verwachting Florida overspoelen nadat hij Cuba zonder stroom heeft verlaten
Orkaan Ian zal naar verwachting Florida overspoelen nadat hij Cuba zonder stroom heeft verlaten
Hoofdlijnen
- Wat zijn de verschillende soorten wetenschappelijke onderzoeken?
- Een algoritme voor het voorspellen van eiwitparen kan helpen aantonen hoe levende systemen werken
- Wat zijn de vijf accessoire organen van het gastro -intestinale systeem?
- Wilgenroosje:de roze pionier
- Voorbeelden van stoffen die gefaciliteerde diffusie gebruiken
- Wat zijn de 3 vormen van bacteriën en hun specifieke naam?
- Wat betekent geconserveerd?
- Hoe wordt DNA gemanipuleerd?
- Welke wetenschapper onderzoekt het menselijk lichaam?
- Een verbeterde inkt voor colon-tatoeages
- Onderzoekers helpen de wet van Moore bij te houden door een nieuwe materiaalklasse te verkennen
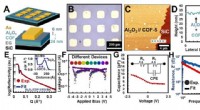
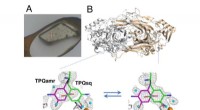
- Onderzoekers ontcijferen structuur van veelbelovende metalen organische raamwerken

- Een manier bedenken om microplastics uit afvalwater te verwijderen - met okra, aloë

- Enzymen ontdooid avontuur:in thermodynamica van kristallo-eiwitten
 Inwoners gewaarschuwd terwijl Louisiana zich schrap zet voor orkaan Ida
Inwoners gewaarschuwd terwijl Louisiana zich schrap zet voor orkaan Ida Nieuw rapport:de wereld wordt overspoeld met fossiele brandstoffen en het is tijd om de toevoer af te sluiten
Nieuw rapport:de wereld wordt overspoeld met fossiele brandstoffen en het is tijd om de toevoer af te sluiten Wat is het buitenste deel van het vrouwelijke voortplantingssysteem?
Wat is het buitenste deel van het vrouwelijke voortplantingssysteem?  Onderzoekers ontdekken een manier om te zien hoe een medicijn een cel hecht
Onderzoekers ontdekken een manier om te zien hoe een medicijn een cel hecht  Wat is de optimale manier om een economie te diversifiëren?
Wat is de optimale manier om een economie te diversifiëren? RIT-onderzoekers winnen eerste plaats in eye-tracking challenge door Facebook Research
RIT-onderzoekers winnen eerste plaats in eye-tracking challenge door Facebook Research Is de Dode Zee echt dood?
Is de Dode Zee echt dood?  Landvervuiling voorkomen
Landvervuiling voorkomen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

