
Wetenschap
Hoeveel liter C2H2 moet worden geproduceerd uit 80 gram H2O?
1. Evenwichtige chemische vergelijking
De reactie die u beschrijft, is de reactie van calciumcarbide (CAC₂) met water (H₂o) om acetyleen (C₂h₂) en calciumhydroxide (Ca (OH) ₂) te produceren:
CAC₂ (S) + 2 H₂O (L) → C₂h₂ (G) + Ca (OH) ₂ (aq)
2. Stoichiometrie
* Molaire massa: Bereken de molaire massa's van de betrokken soorten:
* H₂o:18.015 g/mol
* C₂h₂:26.04 g/mol
* molberekening: Converteer de gegeven massa water (80 g) in mol:
* Mol h₂o =(80 g) / (18.015 g / mol) =4,44 mol
* molverhouding: Gebruik de molverhouding van de gebalanceerde vergelijking om mol c₂h₂ te vinden:
* 2 mol H₂o:1 mol C₂h₂
* Mol c₂h₂ =(4,44 mol H₂o) * (1 mol c₂h₂ / 2 mol H₂o) =2,22 mol C₂h₂
* Volumeberekening: We kunnen de ideale gaswet (PV =NRT) gebruiken om mol C₂h₂ om te zetten in volume. We moeten standaard temperatuur en druk aannemen (STP):
* STP:T =273.15 K, P =1 ATM
* R (ideale gasconstante) =0,0821 L · atm/(mol · k)
* Volume van c₂h₂ =(nrt) / p =(2.22 mol * 0,0821 l · atm / (mol · k) * 273.15 k) / 1 atm = 49,9 l
Daarom moet ongeveer 49,9 liter C₂h₂ worden geproduceerd vanaf 80 gram H₂o.
 Is een flat soda pop homogeen mengsel?
Is een flat soda pop homogeen mengsel?  Nieuwe methode voor het ontwerpen van metabole routes
Nieuwe methode voor het ontwerpen van metabole routes Recycling van broeikasgassen:Nanodeeltjes op perovskietkristallen voorkomen cokesvorming
Recycling van broeikasgassen:Nanodeeltjes op perovskietkristallen voorkomen cokesvorming Gouden nanodeeltjes om toepassingen te vinden in de waterstofeconomie
Gouden nanodeeltjes om toepassingen te vinden in de waterstofeconomie Wat maakt sommige moleculen vrij om vrij te passeren terwijl de doorgang van andere moleculen wordt beperkt?
Wat maakt sommige moleculen vrij om vrij te passeren terwijl de doorgang van andere moleculen wordt beperkt?
 Hoe de popcultuur de juridische opvattingen over vloeken kan (en moet) veranderen
Hoe de popcultuur de juridische opvattingen over vloeken kan (en moet) veranderen  Griekenland geconfronteerd met ecologische ramp door woedende bosbranden
Griekenland geconfronteerd met ecologische ramp door woedende bosbranden Database helpt Canadese tornado's op de kaart te zetten
Database helpt Canadese tornado's op de kaart te zetten VN-klimaatbesprekingen eindigen terwijl de VS standvastig blijft in fossiele brandstoffen
VN-klimaatbesprekingen eindigen terwijl de VS standvastig blijft in fossiele brandstoffen Betekenis van Pacific Northwest Native American Orca Design
Betekenis van Pacific Northwest Native American Orca Design
Hoofdlijnen
- Waarom beschouwen auteurs syndesmosis als een voorbeeld van amfiarthrose?
- Onderzoekers ontdekken hoe wombats kakblokjes uitscheiden
- Wat is de beste beschrijving van evolutie camouflage door natuurlijke selectie?
- Nieuwe voorouder? Wetenschappers denken na over DNA uit Siberië
- Een organel die opgeslagen energie vrijgeeft die voornamelijk uit suikers komt, wordt wat genoemd?
- Hoe lepra werkt
- Nieuwe bevindingen laten zien hoe het influenzavirus menselijke cellen kaapt
- Kunnen uitwerpselen de soort redden?
- Foetale cellen zijn terug te voeren tot de eerste dag van de embryonale ontwikkeling
- Het vergelijken van cryogene structuren met monsters op kamertemperatuur kan helpen bij het identificeren van fouten in rekenmodellen
- Microbiële diefstal maakt afbraak van methaan mogelijk, giftige methylkwik
- Hoe een COVID-19-infectie de bloedcellen op de lange termijn verandert

- Team gebruikt een ernstige vervormingsmethode op bulk magnetische legeringen voor hoge prestaties

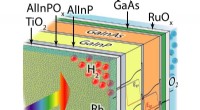
- Nieuw wereldrecord voor directe zonne-watersplitsingsefficiëntie
 Winst Apple stabiel, servicewinst compenseerde iPhone-inzinking
Winst Apple stabiel, servicewinst compenseerde iPhone-inzinking Wat kunnen verwering en erosie doen voor landvormen?
Wat kunnen verwering en erosie doen voor landvormen?  Onbekende helpers van de bodem:hoe ongewervelde dieren afbraakplanten ondersteunen
Onbekende helpers van de bodem:hoe ongewervelde dieren afbraakplanten ondersteunen  Van de 31 Australische politieke biografieën die in het afgelopen decennium zijn gepubliceerd, slechts 4 gingen over vrouwen
Van de 31 Australische politieke biografieën die in het afgelopen decennium zijn gepubliceerd, slechts 4 gingen over vrouwen Welke soorten gassen of elementen vormen normaal gesproken geen verbindingen met andere elementen?
Welke soorten gassen of elementen vormen normaal gesproken geen verbindingen met andere elementen?  Hoe zijn de productie van mannelijke en vrouwelijke gameten anders?
Hoe zijn de productie van mannelijke en vrouwelijke gameten anders?  Onderzoek plaatst natuurbrandrisico in historische context
Onderzoek plaatst natuurbrandrisico in historische context Hoe lang is een seconde op Jupiter?
Hoe lang is een seconde op Jupiter?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

