
Wetenschap
Wat weerspiegelt het oplosbaarheidsproduct dat KSP bevat?
Dit is wat KSP reflecteert:
* evenwicht tussen vaste en opgeloste ionen: KSP vertegenwoordigt de evenwichtstoestand waar een vaste ionische verbinding in contact staat met zijn opgeloste ionen in een verzadigde oplossing.
* Product van ionenconcentraties: KSP wordt gedefinieerd als het product van de molaire concentraties van de ionen die zijn verhoogd tot hun stoichiometrische coëfficiënten in de evenwichtige oplossingsvergelijking. Bijvoorbeeld voor de ontbinding van AgCl:
Agcl (s) <=> Ag + (aq) + cl- (aq)
KSP =[Ag+] [Cl-]
* Spaarzaam oplosbare verbindingen: KSP wordt meestal gebruikt voor verbindingen die een beperkte oplosbaarheid hebben. Dit betekent dat slechts een kleine hoeveelheid van de verbinding oplost in de oplossing bij evenwicht.
* Precipitatie voorspellen: KSP kan worden gebruikt om te voorspellen of een neerslag zal worden gevormd wanneer oplossingen van twee ionische verbindingen worden gemengd. Als het product van de ionenconcentraties de KSP -waarde overschrijdt, zal de neerslag optreden.
Samenvattend weerspiegelt KSP de evenwichtstoestand van een spaarzaam oplosbare ionische verbinding in een oplossing en kwantificeert het maximale product van ionenconcentraties die kunnen bestaan in een verzadigde oplossing voordat neerslag optreedt.
 Ontdekking leidt tot nieuwe verouderingscrème en kippenvoer
Ontdekking leidt tot nieuwe verouderingscrème en kippenvoer Het gedeelte van een organisch molecuul dat verantwoordelijk is voor speciaal gedrag of reactivety wordt een reactieve groep waar onwaar genoemd?
Het gedeelte van een organisch molecuul dat verantwoordelijk is voor speciaal gedrag of reactivety wordt een reactieve groep waar onwaar genoemd?  Waar is een gasplaneet van gemaakt?
Waar is een gasplaneet van gemaakt?  Wetenschappers ontwikkelen een nieuw zelfherstellend interactief hydrogel-touchpad tussen mens en machine
Wetenschappers ontwikkelen een nieuw zelfherstellend interactief hydrogel-touchpad tussen mens en machine Nieuw goedkoop materiaal voor verlichting en diagnostiek produceert wit licht dat zonlicht imiteert
Nieuw goedkoop materiaal voor verlichting en diagnostiek produceert wit licht dat zonlicht imiteert
 Een mogelijke verklaring voor de mysterieuze ijscirkels in het Baikalmeer
Een mogelijke verklaring voor de mysterieuze ijscirkels in het Baikalmeer Onderzoek laat zien hoe monarchvlinders het noordelijke broedgebied herkoloniseren
Onderzoek laat zien hoe monarchvlinders het noordelijke broedgebied herkoloniseren  Wat zegt de Islam over het lot van anderen?
Wat zegt de Islam over het lot van anderen?  Pet-tags koppelen veelgebruikte vlamvertragers aan hyperthyreoïdie bij katten
Pet-tags koppelen veelgebruikte vlamvertragers aan hyperthyreoïdie bij katten Bosbranden verwoesten groot gebied van Oost-Bolivia:NGO
Bosbranden verwoesten groot gebied van Oost-Bolivia:NGO
Hoofdlijnen
- Hoe voert een levend organisme enkele van de 7 levensprocessen uit?
- Wat is de biologische levenscyclus van vleermuizen?
- Hoe zijn de twee zijden van celmembraan anders?
- Welke cellen zijn betrokken bij actieve immuniteit?
- Bestaan hypoallergene katten überhaupt? Drie mythen over kattenallergieën ontkracht
- Zijn mannelijke Y-chromosomen korter dan X-chromosomen?
- Welke ongewervelde dieren heeft een gastrovasculaire holte?
- Onderzoek toont aan hoe de wiskunde- en wetenschappelijke identiteit bij studenten de resultaten op de universiteit en carrière beïnvloedt
- Levensimiterende moleculen tonen het basismetabolisme
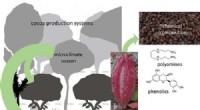
- Gestresste cacaobomen kunnen smaakvollere chocolade produceren
- Big data-techniek onthult voorheen onbekende mogelijkheden van veelgebruikte materialen

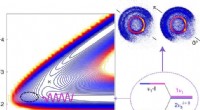
- Kwantumtrillingseigenschappen tussen moleculen gebruiken om reacties tussen verbindingen te versnellen
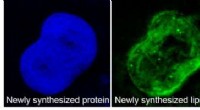
- De innerlijke werking van een levende cel in kaart brengen
- Nieuwe manier om ecstasy te detecteren ontdekt

 Hoe gebruik je het woord fysieke eigenschappen in een zin?
Hoe gebruik je het woord fysieke eigenschappen in een zin?  Wetenschappers simuleren de magnetisatie-omkering van Nd-Fe-B-magneten met behulp van grootschalige eindige-elementenmodellen
Wetenschappers simuleren de magnetisatie-omkering van Nd-Fe-B-magneten met behulp van grootschalige eindige-elementenmodellen  Geen verband tussen nabijheid van terroristische aanslagen in Stockholm en houding tegenover terrorisme
Geen verband tussen nabijheid van terroristische aanslagen in Stockholm en houding tegenover terrorisme Is er zwaartekracht op Ganymede en Callisto?
Is er zwaartekracht op Ganymede en Callisto?  Wat is een voorbeeld van een geconcentreerde oplossing?
Wat is een voorbeeld van een geconcentreerde oplossing?  Voedselketen met drie organismen die Humans
Voedselketen met drie organismen die Humans Unicorn Root herleeft zichzelf na 130 jaar
Unicorn Root herleeft zichzelf na 130 jaar  Wat is de dichtheid van vloeistoffen dan water?
Wat is de dichtheid van vloeistoffen dan water?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

