
Wetenschap
Reageren sterkere zuren langzamer dan zwakkere zuren?
Dit is waarom:
* Zure sterkte gaat over de neiging om een proton te doneren (H+) Sterkere zuren doneren protonen gemakkelijker.
* reactiesnelheid gaat over de snelheid van een reactie . Het hangt af van verschillende factoren, waaronder:
* Botsfrequentie: Hoe vaak reactantmoleculen botsen.
* Activeringsenergie: De minimale energie die nodig is om een reactie te laten optreden.
* oriëntatie: Hoe moleculen botsen, wat gunstig moet zijn voor de reactie.
Sterkere zuren kunnen in sommige gevallen sneller reageren omdat:
* Ze vormen meer reactieve tussenproducten: De geprotoneerde vorm van een zwakkere basis is een betere elektrofiel (trekt elektronen aan) en kan leiden tot snellere reacties.
* Ze kunnen reacties katalyseren: Sterkere zuren kunnen substraten protoneren en hun reactiviteit vergroten.
Het is echter niet altijd waar:
* Andere factoren kunnen de reactiesnelheden beïnvloeden: De aard van de basis, oplosmiddel, temperatuur, enz., Spelen allemaal een rol.
* Zwakkere zuren kunnen soms sneller reageren: Als een zwakker zuur sterischer toegankelijk is of een stabieler tussenproduct vormt, kan het sneller reageren dan een sterker zuur.
Samenvattend:
Zure sterkte en reactiesnelheid zijn verschillende concepten. Hoewel sterkere zuren soms sneller kunnen reageren, is het geen universele regel. Veel andere factoren beïnvloeden de reactiesnelheden.
 Sedimenten uit meren vertonen tientallen jaren van verontreiniging met kolenas
Sedimenten uit meren vertonen tientallen jaren van verontreiniging met kolenas Is het door de wind geblazen slib dat het landschap deken?
Is het door de wind geblazen slib dat het landschap deken?  Wat is het puurste op aarde?
Wat is het puurste op aarde?  Antarctische onderzoekers nemen ijzige duik om zonnewende te markeren
Antarctische onderzoekers nemen ijzige duik om zonnewende te markeren Aardbevingen volgen afvalwaterafvoerpatronen in het zuiden van Kansas
Aardbevingen volgen afvalwaterafvoerpatronen in het zuiden van Kansas
Hoofdlijnen
- Wat wordt het proces genoemd door welke macromeculen worden gevormd?
- Welke cellulaire structuur in een dierlijke cel helpt homeostase te behouden door het transport van stoffen in en uit cel te regelen?
- Wat zijn de ziekteverwekker die borstkanker veroorzaakt?
- Foster-kikkervisjes triggeren het ouderlijk instinct bij gifkikkers
- Wat zijn de voordelen van eiwitexpressie en zuivering?
- Studie beschrijft hoe de driedimensionale architectuur van het genoom verandert tijdens de celcyclus
- Een kleine factor heeft een grote impact op genoombewerking
- Wat is een andere naam voor gemyelineerde axonen?
- Zijn genderverschillen vooraf bepaald?
- Onderzoekers hebben geheimen ontgrendeld over gemanipuleerde eiwitreceptoren, AUTO

- Katalysatorvervroeging verwijdert verontreinigende stoffen bij lage temperaturen

- Duurzame kunststoffen zijn in aantocht

- Upconversion-gebaseerde nanosensor ontwikkeld voor detectie van geneesmiddelen voor chemotherapie
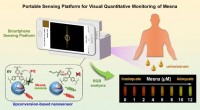
- Onderzoekers bedenken proces om duurzaam rubber te maken, kunststoffen

 Superfotostabiel fluorescerend labelmiddel voor microscopie met superresolutie
Superfotostabiel fluorescerend labelmiddel voor microscopie met superresolutie Een penalty opslaan:hoe de wetenschap de score helpt voorspellen
Een penalty opslaan:hoe de wetenschap de score helpt voorspellen Stripboeken schetsen hoe we reageren op bedreigingen
Stripboeken schetsen hoe we reageren op bedreigingen  Hoe de luchtdrukwaarden te begrijpen
Hoe de luchtdrukwaarden te begrijpen Wolven in een vliegtuig:hoe het opvangcentrum erin slaagde vier ernstig bedreigde pups opnieuw te verwilderen
Wolven in een vliegtuig:hoe het opvangcentrum erin slaagde vier ernstig bedreigde pups opnieuw te verwilderen  Wat telt als natuur? Het hangt er vanaf
Wat telt als natuur? Het hangt er vanaf Wat is Koeweit Herbarium?
Wat is Koeweit Herbarium?  Succes in community college geholpen door uitgebreid casemanagement, studie vondsten
Succes in community college geholpen door uitgebreid casemanagement, studie vondsten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

