
Wetenschap
Welk orbitaal wordt gevuld wanneer fluor één elektron van natrium accepteert?
Dit is waarom:
* Fluor's Electron Configuration: Fluor heeft 9 elektronen, met de configuratie 1S² 2S² 2P⁵. Dit betekent dat het 5 elektronen heeft in zijn 2P -subshell, die maximaal 6 elektronen kan bevatten.
* Natrium's elektronenconfiguratie: Natrium heeft 11 elektronen, met de configuratie 1S² 2S² 2P⁶ 3S¹. Het heeft een enkel elektron in zijn 3S -orbitaal, dat verder weg van de kern is en een hoger energieniveau heeft dan de 2P -orbitalen.
* ionische binding: Wanneer natrium zijn 3S -elektron verliest aan fluor, wordt het een positief geladen ion (Na⁺). Fluorin krijgt dit elektron, voltooit zijn 2P -subshell en wordt een negatief geladen ion (F⁻). Deze overdracht van elektronen vormt een ionische binding tussen de twee atomen.
Daarom wordt de 2P orbitaal van fluor gevuld wanneer het een elektron van natrium accepteert.
 Zeer gevoelige dopaminedetector maakt gebruik van 2D-materialen
Zeer gevoelige dopaminedetector maakt gebruik van 2D-materialen Wie experimenteerde met vloeistoffen en hoe ze reageren onder druk?
Wie experimenteerde met vloeistoffen en hoe ze reageren onder druk?  Rema gebruikte het apparaat om 100 cm3 wateroplosbare inkt te destilleren. Welk proces vindt plaats tijdens de destillatie?
Rema gebruikte het apparaat om 100 cm3 wateroplosbare inkt te destilleren. Welk proces vindt plaats tijdens de destillatie?  Hoe Lbs /Mmscf naar Ppm te converteren
Hoe Lbs /Mmscf naar Ppm te converteren  Verbeterde chemische verwering:een oplossing voor de klimaatcrisis?
Verbeterde chemische verwering:een oplossing voor de klimaatcrisis?
 Sirene klinkt op nucleaire fall-out ingebed in smeltende gletsjers
Sirene klinkt op nucleaire fall-out ingebed in smeltende gletsjers Het aanbrengen van steenstof op akkerlanden kan tot 2 miljard ton CO2 uit de atmosfeer opnemen
Het aanbrengen van steenstof op akkerlanden kan tot 2 miljard ton CO2 uit de atmosfeer opnemen In beleidsvoorbeeld, Democraten richten zich op oceanen voor klimaatactie
In beleidsvoorbeeld, Democraten richten zich op oceanen voor klimaatactie Afbeelding:NASA-satellietbeeld toont lavastroom van vulkaan Hawaï
Afbeelding:NASA-satellietbeeld toont lavastroom van vulkaan Hawaï Onder druk:hoe kamgelei zich heeft aangepast aan het leven op de bodem van de oceaan
Onder druk:hoe kamgelei zich heeft aangepast aan het leven op de bodem van de oceaan
Hoofdlijnen
- Wat is de zuurstofroute als we inademen?
- Waarom gebruiken wetenschappers vertakkingsdiagrammen?
- Wat is een voorbeeld van een gel?
- Hoe de snelste spier ter wereld vier unieke vogelsoorten creëerde
- Waarom wordt voedingsagar gebruikt voor bacteriën en geen schimmels?
- Biomoleculaire condensaten:onderzoek onthult een slechte voorspellende kracht van gevestigde vloeistof-vloeistoffasescheidingstesten
- Welke 3 organische macromoleculen worden vaak gebruikt om ATP te maken door cellulaire ademhaling?
- Is gelelektroforese een belangrijk hulpmiddel dat in de biotechnologie wordt gebruikt voor forensisch onderzoek en vaderschapstests?
- Wat gebeurt er als Gram Positive Cell niet wordt ontkleurd?
- Brandstofcel zorgt voor een frisse wind voor toekomstig stroomalternatief

- Hoe het milieu te helpen:Zet bakolie om in hernieuwbare brandstoffen

- Een kus des doods om het onbedwingbare te verdoven
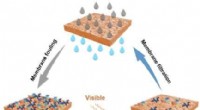
- Wetenschappers ontwikkelen N-gedoteerde zelfreinigende membranen die gebruik maken van bestraling met zichtbaar licht
- Gemanipuleerde enzymen - onderzoekers zetten mijlpaal in onderzoek naar biokatalyse

 Amerikaanse boete op Facebook zet CEO Zuckerberg aan de haak
Amerikaanse boete op Facebook zet CEO Zuckerberg aan de haak Uit onderzoek blijkt dat meer dan de helft van het water uit de Colorado Rivers wordt gebruikt om gewassen te irrigeren
Uit onderzoek blijkt dat meer dan de helft van het water uit de Colorado Rivers wordt gebruikt om gewassen te irrigeren  Is er een gemeenschappelijk geluid van vloeken in alle talen?
Is er een gemeenschappelijk geluid van vloeken in alle talen?  Zero-carbon bitcoin? De eigenaar van een kerncentrale in Pennsylvania denkt dat hij goud kan slaan
Zero-carbon bitcoin? De eigenaar van een kerncentrale in Pennsylvania denkt dat hij goud kan slaan Welke kleur en temperatuur is de ster Cygny?
Welke kleur en temperatuur is de ster Cygny?  Drie teams tonen onafhankelijk van elkaar aan dat dipolaire kwantumgassen de toestand van supersolide eigenschappen ondersteunen
Drie teams tonen onafhankelijk van elkaar aan dat dipolaire kwantumgassen de toestand van supersolide eigenschappen ondersteunen  In ons, veranderend zelfbeeld kan het welzijn verminderen
In ons, veranderend zelfbeeld kan het welzijn verminderen Stropers bedreigen kostbaar Madagaskar-bos en lemuren
Stropers bedreigen kostbaar Madagaskar-bos en lemuren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

