
Wetenschap
Wordt het proces van KNO3 opgelost in water spontaan bij alle bestudeerde temperaturen?
Dit is waarom:
* Oplossing is een endotherme proces voor KNO3: Dit betekent dat energie wordt geabsorbeerd uit de omgeving wanneer KNO3 oplost in water.
* spontaniteit wordt bepaald door Gibbs Free Energy (ΔG): Δg =ΔH - Tδs
* ΔH is de enthalpie -verandering (positief voor endothermische reacties)
* T is de temperatuur in Kelvin
* AS is de entropiewijziging (over het algemeen positief voor oplossing)
Bij lage temperaturen:
* ΔH (positief) is de dominante factor.
* De negatieve waarde van Tδs is kleiner dan AH.
* Daarom is Ag positief en is de oplossing niet-spontaan.
Bij hoge temperaturen:
* De Tδs -term wordt significanter naarmate de temperatuur toeneemt.
* Als de temperatuur hoog genoeg is, kunnen Tδs groter worden dan AH.
* Ag wordt negatief en de oplossing wordt spontaan.
Samenvattend:
* KNO3 oplossen in water is niet-spontaan bij lage temperaturen Omdat de energie die nodig is om de ionische bindingen in KNO3 te verbreken groter is dan de energie die wordt verkregen door de verhoogde entropie.
* Bij hogere temperaturen , de entropiewinst wordt belangrijker en de oplossing wordt spontaan .
Er bestaat een specifieke temperatuur (de oplosbaarheidstemperatuur) waarboven KNO3 spontaan oplost in water. Deze temperatuur wordt bepaald door de balans tussen enthalpie en entropiewijzigingen.
 Chloride -ion en het chlooratoom hebben hoeveel elektronenconfiguraties?
Chloride -ion en het chlooratoom hebben hoeveel elektronenconfiguraties?  Wat is de formulenaam voor koperen en stikstof?
Wat is de formulenaam voor koperen en stikstof?  Wat is de pH -waarde van stikstof?
Wat is de pH -waarde van stikstof?  Wat is een voorbeeld voor de eigenschappen van zout, anders dan elementen die gaan om ze te maken?
Wat is een voorbeeld voor de eigenschappen van zout, anders dan elementen die gaan om ze te maken?  Hygroscopische polymere gels:het verzamelen van zoet water en energie uit luchtvochtigheid
Hygroscopische polymere gels:het verzamelen van zoet water en energie uit luchtvochtigheid
 Warmteverlies van de aarde zorgt ervoor dat de ijskap naar de zee schuift
Warmteverlies van de aarde zorgt ervoor dat de ijskap naar de zee schuift Littekens achtergelaten door Australische onderzeese aardverschuivingen onthullen toekomstig tsunami-potentieel
Littekens achtergelaten door Australische onderzeese aardverschuivingen onthullen toekomstig tsunami-potentieel De hoofdstad van Senegal overstroomt opnieuw omdat experts de slechte planning de schuld geven
De hoofdstad van Senegal overstroomt opnieuw omdat experts de slechte planning de schuld geven Het geologische record van modderafzettingen
Het geologische record van modderafzettingen Inspanningen om de toendra te beschermen
Inspanningen om de toendra te beschermen
Hoofdlijnen
- Wat is het verschil tussen een cel en weefsel?
- Wat zijn de twee belangrijkste afdelingen van de celcyclus?
- Hoe draken werken
- Hoop op een van 's werelds zeldzaamste primaten:eerste telling van Zanzibar Red Colobus-aap
- Volgens de evolutietheorie, hoe zijn mensen en verwant?
- Wetenschappers ontdekken hoe hormonen hun effecten bereiken
- Wat is S-fase van interfase?
- Wat ontdekte Mendel Gregor dat zich aan DNA heeft gerealiseerd?
- Onderzoek laat zien hoe een sleuteleiwit het proces van meiose mogelijk maakt
- Wetenschappers onthullen routekaart om de ontwikkeling van osteoporosebehandeling te ondersteunen

- Karakterisering van de tijdsafhankelijke materiaaleigenschappen van eiwitcondensaten

- de dodelijke, levengevende en voorbijgaande elementen die deel uitmaken van groep 15 van het periodiek systeem

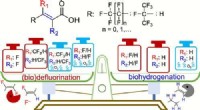
- Onder anaërobe omstandigheden kunnen gewone microbiële gemeenschappen de ultrasterke koolstof-fluorbinding verbreken
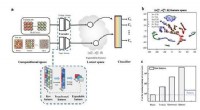
- Kristalstructuurvoorspelling van willekeurige legering met meerdere elementen
 Wat werkt 114 kilo in ponden?
Wat werkt 114 kilo in ponden?  Hoe stimuleert groene energie de bedrijfsgroei?
Hoe stimuleert groene energie de bedrijfsgroei?  Wat voor soort oplossing wordt gevormd als hydroxide oplost in water?
Wat voor soort oplossing wordt gevormd als hydroxide oplost in water?  Robotica, coderen wordt kinderspel:KOOV Trial Kit
Robotica, coderen wordt kinderspel:KOOV Trial Kit Natuurkundige schat het effect van donkere materie op de schaduw van een zwart gat
Natuurkundige schat het effect van donkere materie op de schaduw van een zwart gat Wat was het wetenschappelijke idee dat Earth Centre of Universe?
Wat was het wetenschappelijke idee dat Earth Centre of Universe?  Snapchat Time Machine is een selfie-veranderende functie waarmee je voor je ogen ouder kunt worden
Snapchat Time Machine is een selfie-veranderende functie waarmee je voor je ogen ouder kunt worden Studie test de veerkracht van de Salish Sea tegen de gevolgen van klimaatverandering
Studie test de veerkracht van de Salish Sea tegen de gevolgen van klimaatverandering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

