
Wetenschap
Wat is de elektronenconfiguratie van B3?
B3 is geen stabiele soort. Het is een onstabiel kation (positief ion) van boor (b), dat 5 elektronen heeft in zijn neutrale toestand.
Dit is waarom:
* Boor's elektronische configuratie: Het neutrale booratoom heeft de elektronische configuratie 1S²2S²2P¹. Dit betekent dat het 3 valentie -elektronen in zijn buitenste schaal heeft (2S²2P¹).
* B3+ ionenvorming: Om B3+te vormen, zou Boron alle 3 van zijn valentie -elektronen moeten verliezen. Dit zou het achterlaten met een lege buitenste schaal, wat resulteert in een zeer onstabiel kation met een +3 lading.
Daarom bestaat er geen stabiele elektronenconfiguratie voor B3+.
Het is belangrijk op te merken dat B3+ kan worden waargenomen in extreem energieke omgevingen, maar het zou geen stabiele of gewone soort zijn.
 Effecten van kustbeschermingsconstructies vinden plaats over decennia
Effecten van kustbeschermingsconstructies vinden plaats over decennia Heidense betekenis van groenblijvende & hulst
Heidense betekenis van groenblijvende & hulst  Afbeelding:staat Washington lijdt onder Williams Flats Fire veroorzaakt door bliksem
Afbeelding:staat Washington lijdt onder Williams Flats Fire veroorzaakt door bliksem Michael verzwakt tot tropische storm na dag van verwoesting in Florida
Michael verzwakt tot tropische storm na dag van verwoesting in Florida Onderzoek onderzoekt voor het eerst de voordelen en kosten van nieuwe waterhergebruiksystemen
Onderzoek onderzoekt voor het eerst de voordelen en kosten van nieuwe waterhergebruiksystemen
Hoofdlijnen
- Hoe de eenvoudige goudsbloem een verwoestende tomatenplaag te slim af is
- Onderzoek naar fruitvliegen werpt licht op hoe organismen de voedings- en vastencycli reguleren
- Door het uitbreiden van het DNA-alfabet kunnen cellen nieuwe eiwitten produceren
- Wetenschappers ontdekken hoe dodelijke schimmel zichzelf beschermt
- Hoe brassinosteroïde-signalering ervoor zorgt dat wortels langer groeien bij stikstofgebrek
- Hoe ondersteunt homologe structuur de evolutietheorie?
- Wat zijn restrictie -enzymen?
- Wat is de generalisatie van de Filipijnse wetenschapper?
- Zijn nucleïnezuren gevonden in levende wezens?
- Wetenschappers lossen structuur van eiwit met verstandelijke beperking op

- Synthetische bedrukte polymeren herkend door DNA
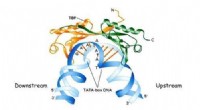
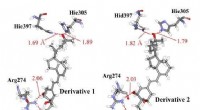
- Chiraliteit van vitamine D-derivaat beïnvloedt de protoneringstoestanden van zijn receptoreiwit
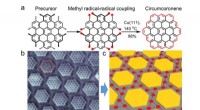
- Synthese op het oppervlak van grafeenmoleculen en hun superroosters
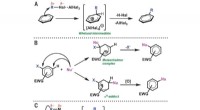
- Calciumverbinding breekt zoals stoot als regel af
 Wat is oppervlaktespanning?
Wat is oppervlaktespanning?  Voorkomt dat de temperatuur van het oppervlak snel verandert?
Voorkomt dat de temperatuur van het oppervlak snel verandert?  Nieuwe kleurensensoren zijn minder duur om te produceren
Nieuwe kleurensensoren zijn minder duur om te produceren Jupiter-achtige exoplaneten gevonden in sweet spot in de meeste planetaire systemen
Jupiter-achtige exoplaneten gevonden in sweet spot in de meeste planetaire systemen Onderzoek van Japanse en Amerikaanse Twitter-gebruikers werpt licht op waarom emotionele berichten eerder viraal gaan
Onderzoek van Japanse en Amerikaanse Twitter-gebruikers werpt licht op waarom emotionele berichten eerder viraal gaan Hoeveel watermoleculen bevat 15 mol?
Hoeveel watermoleculen bevat 15 mol?  Hoe beheert warmte -effectspanning.?
Hoe beheert warmte -effectspanning.?  Opinie:Waarom bioplastics onze plasticproblemen niet zullen oplossen
Opinie:Waarom bioplastics onze plasticproblemen niet zullen oplossen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

